高二年级(前三章)化学练习
可能用到的相对原子质量: Fe—56 Cu—64
一、选择题(每小题只有一个至二个符合题意的选项)
1.下列反应起了氮的固定作用的是
A.N2与H2在一定条件下反应生成NH3 B.NO与O2反应生成NO2
C.NH3经催化氧化生成NO D.由NH3制碳铵和硫铵
![]()
![]() 2.设C+CO2 2CO-Q1,反应速度为V1, N2+3H2 2NH3+Q2,反应速度为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
2.设C+CO2 2CO-Q1,反应速度为V1, N2+3H2 2NH3+Q2,反应速度为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
A.同时增大 B.同时减小 C.增大,减小 D.减小,增大
3.冰箱致冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3→ClO+O2 ,ClO+O→Cl+O2下列说法不正确的是
A.反应后将O3转变为O2 B.Cl原子是总反应的催化剂
C.氟氯甲烷是总反应的催化剂 D.Cl原子反复起分解O3的作用
4.中和一定量的某种醋酸溶液共消耗NaOH溶液a g。若先在该醋酸溶液中加入少量醋酸钠,再用上述NaOH溶液中和,消耗NaOH溶液b g。则a与b的关系是
A.a=b B.a<b C.a>b D.无法确定
5.在一定温度下用蒸馏水稀释乙酸溶液,下列符合所表示的数值始终保持增大趋势的是
![]() A.[CH3COOH] B.KW C.[CH3COOH]/[H+] D.[OH-]/[H+]
A.[CH3COOH] B.KW C.[CH3COOH]/[H+] D.[OH-]/[H+]
6.某工业生产中发生反应:2A(g)+B(g)2M(g),△H<0 (注:△H<0的反应为放热反应,下同)。下列有关该工业生产的说法正确的是
A.工业上在合成M时,一定采用高压条件,因为高压有利于M的生成
B.由于物质B价廉易得,因此工业上一般采用加入过量的B,以提高A的转化率
C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为使用催化剂可提高M的日产量
7.下列物质中指定微粒的数目之比是1:1的是
A.NaHSO4溶液中Na+和H+ B.明矾KAl(SO4)2晶体中K+和Al3+
C.NaF溶液中Na+与F- D. 1123Na+电子数与中子数
8.下列各组物质均在试管里进行反应,反应过程中,在试管口观察不到红棕色气体出现的是
A.浓硝酸和铜片共热 B.浓硫酸和铜片共热
C.稀硝酸和铜片共热 D.浓硫酸和硝酸钾晶体、铜片共热
9.下列叙述中不正确的是
A.PH=14与PH=12的两种NaOH溶液等体积混合后, ![]()
B.用未知浓度的碘水滴定0.1mol/L的Na2SO3溶液时,可用淀粉作指示剂
C.浓度为1×10—10mol/L的KOH溶液的PH值最接近于7
D.常温下PH=1的盐酸溶液中水的电离程度与PH=13的Ba(OH)2溶液中水的电离程度一定相同
![]() 10.在固定体积的密闭容器中,可逆反应nA(g) + mB(g) pC(g),△H<0。当反应达到平衡时,下列说法正确的是
10.在固定体积的密闭容器中,可逆反应nA(g) + mB(g) pC(g),△H<0。当反应达到平衡时,下列说法正确的是
A.增大压强,C的物质的量增加,则m+n<p;
B.加入催化剂,A、B、C的总物质的量不变 C.降低温度,混合气体的密度不变
D.加入B达到新的平衡状态时,A跟B的物质的量都比原平衡中的小
11.已知同条件下能进行下列反应:A+B=C,C+D=B+E+F。则有关总反应:A+D=E+F的下列说法中不正确的是
A.物质B能作为总反应A+D=E+F的催化剂
B.物质C能作为总反应A+D=E+F的催化剂
C.只有B或C存在时才能发生总反应A+D=E+F
D.物质B或C都能作为总反应A+D=E+F的催化剂
12.一定温度下,要使0.1mol/L的醋酸溶液中,c(H+)与醋酸的电离程度都减小,可加入少量试剂 A.水 B.醋酸钠 C.盐酸 D.冰醋酸
![]() 13.在一定条件下,固定体积的密闭容器中,可逆反应:2NO+O2 2NO2达到平衡的标志是
A.混合气体的颜色不再变化 B.NO、O2、NO2的分子个数之比为2 :1 :2
13.在一定条件下,固定体积的密闭容器中,可逆反应:2NO+O2 2NO2达到平衡的标志是
A.混合气体的颜色不再变化 B.NO、O2、NO2的分子个数之比为2 :1 :2
C.反应混合物中各组分的物质的量浓度相等 D.混合气体的平均相对分子质量不变
14.25℃时,PH值为4的 FeCl3溶液和PH为10的K2CO3溶液中,水的电离程度分别为a1和a2,则它们的大小关系是
A.a1> a2 B.a1 <a2 C.a1 =a2 D.无法确定
15.对于弱电解质的稀溶液,温度一定时,物质的量浓度加水稀释原来的1/n时,其电离程度将增大到原来的√n倍,现有PH=2的某一元弱酸溶液10ml,加水到1L后,溶液的PH值
A.等于4 B.在3~4之间 C.等于3 D.在2~3之间
16.在pH=1的无色溶液中能大量共存的离子组是
A. NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
17.对于反应:A+B=AB来说,常温时按以下情况进行反应:(1)20mL溶液中含A、B各0.01mol;(2)50mL溶液中含A、B各0.05mol;(3)0.1mol·L—1的A、B溶液各10mL混合;(4)0.5mol·L—1的A、B溶液各50mL混合。这四者反应速率的大小关系是
A.(2)>(1)>(4)>(3) B.(4)>(3)>(2)>(1) C.(1)>(2)>(4)>(3) D.(1)>(2)>(3)>(4)
18.能证明HF是弱电解质的事实是
A.HF在所有卤化氢中热稳定性是最强的 B.0.5mol/L氟化钠溶液,其PH值大于7
C.浓硫酸加入氟化钠固体,有氟化氢气体产生 D.0.1mol/LHF溶液其PH=4
选择题答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 | ||||||||||
19.用标准盐酸滴定未知浓度NaOH溶液,下列各操作中,不会引起实验误差的是
A.蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 ( )
B. 蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH进行滴定
C. 碱式滴定管量取10.00mlNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D.用碱式滴定管量取10.00mlNaOH溶液放入用NaOH溶液过的锥形瓶中,再加入适量蒸馏水进行滴定
20.在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,则混和之前,该强酸pH值与强碱pH值之间应满足的关系是 .
21.将PH值都等于3的醋酸和盐酸,加水稀释到a ml和b ml,测得稀释后的溶液PH值均为5,则稀释后两溶液的体积 (填“=”、“>”、“<”、“无法确定”=
22.25℃时,在浓度均为0.1mol/l(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中NH4+离子浓度分别为a、b、c,则a、b、c的大小关系为 。
23.0.02mol/L的HCN溶液与0.02mol/L NaCN溶液等体积混合,已知该混合溶液中![]() ,用“>、<、=”符号填空
,用“>、<、=”符号填空
①溶液中![]()
![]() ②[HCN]
②[HCN]
![]()
③[HCN]+![]() 0.02mol/L
0.02mol/L
24.下图![]() 分别代表有关反应中的一种物质,请填下以下空白。
分别代表有关反应中的一种物质,请填下以下空白。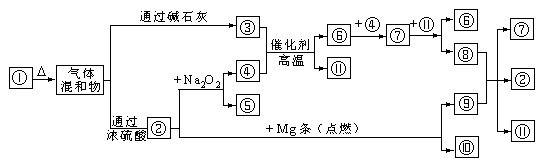
(1)①、③、④的化学式分别是 、
、 。
(2)⑧与⑨反应的化学方程式是
。
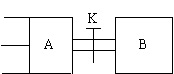 25、如图,A中有一可自由移动的活塞,
25、如图,A中有一可自由移动的活塞,
关闭开关K,先向B中充入2molX和2molY,再向A
中充入1molX和1molY。起始时A、B的体积都为aL,
在相同的温度和有催化剂存在的条件下,两容器中都
开始发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g),反应达到平衡时,A的体积为1.2aL,则:
2Z(g)+W(g),反应达到平衡时,A的体积为1.2aL,则:
(1)A中X的转化率![]() (A)= 。
(A)= 。
(2)A、B中X的转化率![]() (A)
(A) ![]() (B)(填“>”、“<”或“=”)。
(B)(填“>”、“<”或“=”)。
(3)打开开关K,保持温度不变,再达平衡时,A的体积为 L(连通管中气体体积不计)。
三、计算题
26.将8gCu和CuO的混合物全都溶于36ml 15mol/L的浓HNO3中,同时收集到标准状况下的红棕色气体4.48L。反应后用蒸馏水将溶液稀释至100mL,从中取出10mL与10ml3.6mol/LNaOH混合。(不考虑NO2转化为N2O4及溶液体积变化情况),试求:
(1)原混合物CuO的质量;
(2)反应后有多少克沉淀从溶液中析出;
(3)反应后所得溶液的PH.
选择题答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | A | C | A | D | BD | A | B | AC | BC |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 | BD | B | AD | C | C | A | A | BD | ||
19、C
20、PH酸+PH碱= 15
21、无法确定
22、c﹥a﹥b
23、﹥,﹥,=
24、(1)(NH4)2CO3或NH4HCO3,NH3,O2 (2)4HNO3 + C ![]() CO2 ↑+ 4NO2 ↑+ 2H2O
CO2 ↑+ 4NO2 ↑+ 2H2O
25、40%;﹥;2.6a
26、(1)1.6g (2)1.176g (3) PH=13