第一学期期终测试
高二年级(文科)化学试题卷
命题人:胡樟洄 审核人:姜永良
第Ⅰ卷 选择题(共60分)
可能用到的相对原子质量:Zn 65 Al 27 Fe 56 Mg 24 Cu 64 C 12 H 1 O 16 Na 23
一、选择题(本题包括30小题,每小题只有一个正确答案,每小题2分共60分)
1、下列用途中,应用了氮气不活泼性的是
A、用于合成氨气 B、用液氮做制冷剂
C、焊接金属时的保护气 D、工业上以N2为原料之一制硝酸
2、实验室制取下列气体时,只能用排水法收集的是
A、CH4 B、CO2 C、NO D、NO2
3、在下列过程中,需要加快反应速率的是
A、炼钢 B、食物腐败 C、钢铁腐蚀 D、塑料老化
4、某一反应物的浓度是2.0mol/L,经过20s后,它的浓度变成了0.4mol/L,在这20s内它的反应速率为
A、0.1 mol/(L·s) B、0.08mol/(L·s) C、1.6mol/(L·s) D、0.02 mol/(L·s)
5、化学平衡发生移动的原因是
A、正反应速率与逆反应速率都发生了变化
B、正反应速率与逆反应速率都加快了
C、正反应速率不等于逆反应速率
D、平衡混合物中,各组分成分的浓度都发生了变化
6、在一定条件下,发生反应:2NO2![]() N2O4,该反应达到化学平衡后,降低温度,混合物的颜色变浅,下列有关说法正确的是
N2O4,该反应达到化学平衡后,降低温度,混合物的颜色变浅,下列有关说法正确的是
A、正反应为放热反应 B、正反应为吸热反应
C、降温后NO2的浓度增大 D、降温后各物质的浓度不变
7、对于达到平衡状态的可逆反应:N2+3H2![]() 2NH3(正反应为放热反应)下列叙述正确的是:
2NH3(正反应为放热反应)下列叙述正确的是:
A、反应物和生成物的浓度相等 B、N2和H2的浓度之比一定为1:3
C、降低温度,平衡混合物里NH3的浓度增大 D、增大压强,不利于氨的合成
8、碳酸钠俗称纯碱,其原因是
A、由于碳酸钠的纯度很高 B、由于其物质的分类属于碱类
C、由于碳酸钠和酸反应生成盐和水 D、由于碳酸钠水溶液的碱性较强
9、下列电离方程式正确的是
A、H2S![]() 2H+ + S2— B、NaHCO3 == Na+ + H+ + CO32—
2H+ + S2— B、NaHCO3 == Na+ + H+ + CO32—
C、H2CO3![]() H+ + HCO3— D、HClO == H+ + ClO—
H+ + HCO3— D、HClO == H+ + ClO—
10、随着人们生活质量不断提高废电池必须集中处理的问题提到议事日程,其主要原因是
A、利用电池外壳的金属材料
B、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C、不使电池中渗泄的电解液腐蚀其他物品
D、回收其中的石墨电极
11、硝酸应避光保存是因为它具有
A、不稳定性 B、强酸性 C、强氧化性 D、挥发性
12、下列物质中,属于两性氧化物的是
A、 MgO B、 CO2 C、 Al2O3 D、 SO2
13、人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,主要由于维生素C具有
A、酸性 B、碱性 C、氧化性 D、还原性
14、下列物质中,不能用单质直接化合而得到的是
A、FeCl3 B、FeCl2 C、FeS D、Fe3O4
15、取两份铝粉,第一份加足量盐酸,第二份加足量氢氧化钠溶液,如要放出等体积气体(同温同压下),则两份铝粉的质量之比为
A、1:2 B、1:3 C、3:2 D、1:1
16、目前已经发现和通过人工合成的有机物有一千多万种。有机物种类繁多的主要原因是
A、碳元素可以与许多其它元素结合而形成化合物
B、有机物不但存在于动植物体内,而且可以通过人工的方法合成
C、碳元素在自然界中的含量丰富,故形成化合物的种类多
D、碳原子含有4个价电子,可以跟其它原子形成4个共价健,也可以在碳原子跟碳 原子间形成共价键,从而形成长的碳链
 17、下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是
17、下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是
18、适宜做心脏起搏器电源的电池是
A、普通干电池 B、铅蓄电池 C、锂电池 D、新型燃料电池
19、下列叙述中错误的是
A、点燃甲烷不必象点燃氢气那样事先验纯
B、甲烷燃烧能放出大量的热,所以是一种很好的气体燃料;
C、煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生
D、如果隔绝空气,将甲烷加热到1000℃以上,能分解成炭黑和氢气
20、下列烷烃的一氯代物没有同分异构体的是
A、2-甲基丙烷 B、丙烷 C、丁烷 D、乙烷
21、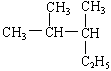 的名称是
的名称是
A、2—甲基—3—乙基丁烷 B、3,4—二甲基戊烷
C、2,3—二甲基—4—乙基丙烷 D、2,3—二甲基戊烷
22、下列哪一种试剂加入氯化铁溶液中,溶液呈血红色
A、H2S B、KSCN C、NaOH D、AgNO3
23、下列体液pH小于7的是
A、胃液 B、尿液 C、唾液 D、血液
24、在下列反应中,光照对反应几乎没有影响的是
A、氯气与氢气的反应 B、氯气与甲烷的反应
C、甲烷与氧气的反应 D、次氯酸的分解
25、物质的量浓度都是0.1mol/l的下列各溶液中,PH值最大的是
A、HCl B、Al2(SO4)3 C、H2SO4 D、CH3COONa
26、A、B、C都是金属,把A放入C的盐溶液中,A的表面附着一层C;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序是
A、A>B>C B、A>C>B C、B>A>C D、B>C>A
27、只用一种试剂,可区别Na2SO4、MgSO4、AlCl3、NH4Cl四种溶液,这种试剂是
A、HCl B、BaCl2 C、AgNO3 D、NaOH
28、下列关于甲烷和乙烯的说法中,不正确的是
A、它们所含元素的种类相同,但甲烷属饱和烃,乙烯属不饱和烃
B、甲烷与氯气能发生取代反应,乙烯与氯气能发生加成反应
C、甲烷和乙烯均能发生氧化反应
D、甲烷中碳的含量比乙烯中碳的含量大
29、某有机物燃烧后的产物只有二氧化碳和水,关于该有机物的判断正确的是
A、该有机物一定是烃 B、该有机物一定含碳、氢元素
C、该有机物一定含碳、氢、氧三种元素 D、该有机物分子内一定只含碳碳单键
30、试管中盛有少量白色固体,可能是铵盐,检验的方法是
A、 加水,将湿润的红色石蕊试纸放在试管口
B、 加氢氧化钠溶液,加热,滴入酚酞试剂
C、 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
D、加氢氧化钠溶液,加热,滴入紫色石蕊试剂
第Ⅱ卷 非选择题(共40分)
二、填空题(本题包括3小题,共18分)
31、写出下列反应的化学方程式:
1、实验室制取乙炔 ;
2、氯化铝溶液中滴加过量氨水(写离子方程式) ;
3、乙烯通入溴的四氯化碳溶液 。
32、冶炼金属常用以下几种方法:①以C或CO、H2作还原剂还原②电解法③热分解法,现冶炼下列金属Al、Fe、Hg,试标明适宜的冶炼方法(填序号):
Al Fe Hg 。
33、把下列物质的相互关系填入下表中的空格中(填序号)
①同种物质 ②同位素 ③同系物 ④同素异形体 ⑤同分异构体
| 物质名称 | 相互关系 |
| 丙烷与2-甲基丙烷 | |
| 金刚石和石墨 | |
| 辛烷与壬烷 | |
| 氯仿与三氯甲烷 | |
| 氕、氘、氚 | |
| 新戊烷与2-甲基丁烷 |
三、实验题(本题包括2小题,共12分)
34、分别除去下列各物质中的杂质,在空白处写出所用试剂的化学式
(1)除去MgCl2中混有的少量MgCO3,可选用试剂 ;
(2)除去铁粉中混有的少量铝粉,可选用试剂 ;
(3)除去乙烷中混有的少量乙烯,可选用试剂 。
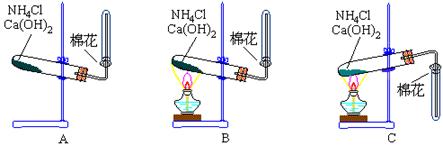 |
35、实验室制取氨气,回答下列问题:
⑴ 应选下面的 (填编号)装置。
⑵ 此反应的化学方程式为
⑶ 检查氨气是否集满的方法是:在收集氨气的试管口处,放一小块润湿的红色石蕊试纸,待试纸变 色时,说明试管中的氨气已收集满了。
四、计算题(本题包括2小题,共10分)
36、取等质量的镁、铝合金,与足量的盐酸和NaOH溶液反应时,分别生成8.96L(标
况)和6.72L(标况)氢气。
则该合金中镁、铝分别为:镁 mol 铝 mol
37、燃烧11.2L(标准状况)甲烷,生成二氧化碳和水的物质的量各是多少?
| 座位号 | |
|
|
|
![]()

高二年级(文科)化学答题卷
一、选择题(每小题只有一个正确答案,每题2分,共60分)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | C | A | B | C | A | C | D | C | B |
| 题序 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | C | D | B | D | D | A | C | A | D |
| 题序 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | D | B | A | C | D | C | D | D | B | C |
二、填空题(本题包括3小题,共18分)
31、![]() 、
、
![]() 、
、
![]() 。
。
32、 ② 、 ① 、 ③ .
33、把下列物质的相互关系填入下表中的空格中(填序号)
①同种物质 ②同位素 ③同系物 ④同素异形体 ⑤同分异构体
| 物质名称 | 相互关系 |
| 丙烷与2-甲基丙烷 | 3 |
| 金刚石和石墨 | 4 |
| 辛烷与壬烷 | 3 |
| 氯仿与三氯甲烷 | 1 |
| 氕、氘、氚 | 2 |
| 新戊烷与2-甲基丁烷 | 5 |
三、实验题(本题包括2小题,共12分)
34、(1) HCl (2) NaOH (3) KMnO4(H+)
35、(1) B
(2) ![]()
(3) 蓝色
四、计算题(本题包括2小题,共10分)
36、镁 0.1 mol 铝 0.2 mol
37、nC(CH4)=11.2L/(22.4L/mol)=0.5mol
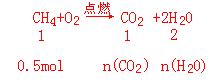
n(CO2)=0.5mol n(H2O)=1mol