高二年级第一学期化学阶段测试试卷
注:以下答案请全部做在答案卷上。
一、选择题:(每题只有一个正确答案,4分×8=32分)(注:教改班3分一个)
1.常温下浓硝酸与下列金属反应最剧烈的是
A.铝 B.铁 C.铜 D.金
2.下列现象的产生与人为排放大气污染物氮氧化物无关的是
A 闪电 B 光化学烟雾 C 酸雨 D 臭氧层空洞
3.有857名科学院院士评出的“98中国十大科技成果”,其中一项是合成一维纳米氮化镓。已知镓是第三主族元素,那么氮化镓的化学式可能是
A.Ga3N2 B.Ga2N2 C.GaN D.Ga3N5
4.农业及城市生活污水中含磷,处理这类污水时要不要除去磷,有以下几种意见,你认为正确的是
A、磷是生物的营养元素,不必除去
B、含磷的污水是很好的肥料,不必处理
C、含磷的污水排入江河中,能引起藻类过度繁殖,使水变质,必须处理
. D、磷对人无毒,除去与否都无关紧要
5.下列反应中,能瞬间完成的是
A.石油的形成 B.硝酸银溶液与盐酸反应
C.钢铁生锈腐蚀 D.白薯发酵制造白酒
6.在2A+B ![]() 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) = 0.3 mol·L-1·S-1
 C.υ(C) = 0.8mol·L-1·S-1
D.υ(D)= 1 mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1
D.υ(D)= 1 mol·L-1·S-1
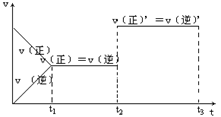
7.如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压滴管胶头,
使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。
则气体X和液体Y不可能是
A.X是NH3,Y是水 B.X是NO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸 D.X是HCl,Y是NaNO3稀溶液
8.若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A、2ω1=ω2 B、2ω2=ω1 C、ω2>2ω1 D、ω1<ω2<2ω1
二、选择题:(每题有1~2个正确答案,4分×10=40分)
9.某一无色晶体要鉴定它是否为硫酸铵,下列操作必要的是
A. 加入NaOH溶液并加热,检验产生气体的性质
B. 加热有无气体放出
C. 晶体用蒸馏水溶解,用盐酸酸化,再加入BaCl2观察有无沉淀生成
D. 晶体溶解,加入Ba(NO3)2溶液,再加入HNO3看有无沉淀生成
10.由于发生氧化-还原反应而不能在溶液中大量共存的离子组是
A.OH-、Na+、HCO3-、K+ B. NH4+、H+、NO3-、SO32-
C.Na+、OH-、Cl-、CO32- D. Ba2+、K+、SO42-、Cl-
11.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(气)+B(气)![]() 2C(气) 若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(气) 若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是
A.①③ B. ①④ C. ②③ D. ③④
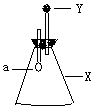
12. 反应2X(g)+Y(g)
反应2X(g)+Y(g) ![]() 2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如右图。下列判断正确的是
2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如右图。下列判断正确的是
A. T1<T2 , 正反应为放热反应
B. T1>T2 ,正反应为吸热反应
C. T1>T2 ,逆反应为吸热反应
D. T1<T2 ,逆反应为放热反应
13.某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A、均减半 B、均加倍 C、均增加1mol D、均减少1mol
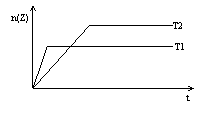
 14.对于一个气态反应体系,下图表示的是反应速率和时间关系,其中t1为达到平衡所需时间,则t2~t3是改变什么条件时可能出现的情况
14.对于一个气态反应体系,下图表示的是反应速率和时间关系,其中t1为达到平衡所需时间,则t2~t3是改变什么条件时可能出现的情况
A.加压 B.增大反应物浓度
C.减压 D.加入催化剂
15.有一可逆反应:2A(气)+ 3B(气)![]() XC(气)+4D(气)若按下列两种配比在同温同容积的密闭容器中进行反应(1) 0.8molA,1.2molB,1.2molC,2.4molD
XC(气)+4D(气)若按下列两种配比在同温同容积的密闭容器中进行反应(1) 0.8molA,1.2molB,1.2molC,2.4molD
(2) 1.4molA,2.1molB,0.6molC,1.2molD达到平衡后,C的百分含量相等,则方程式中x 的值为
A. 1 B. 2 C. 3 D. 4
16.0.1 mol Cu2S与HNO3反应,若生成Cu(NO3)2 、NO、S、H2O,则下列说法中正确的是
A、未被还原的硝酸的物质的量为0.4mol B、参加反应的硝酸物质的量为0.4mol
C、转移电子的物质的量为0.4 mol D、被氧化的元素为硫
17.用下列反应制取O2的过程中:①KClO3(MnO2)分解②Na2O2加水③H2O2加热④KmnO4分解,若制得等质量的O2,电子转移数目比依次是
A.1:1:1:1 B. 2:1:1:2 C. 3:2:2:4 D. 1:2:2:1
18.下面是实验室制取氨气的装置和选用的试剂,其中错误的是



A B C D
三、填空题:
19.(8分)氮有多种氧化物,其中之一的N2O3极不稳定,在液体或蒸气中大部分分离成NO和NO2,因而在NO氧化为NO2的过程中几乎没有N2O3生成,同样亚硝酸也不稳定,在微热甚至冷的条件下即分解。亚硝酸钠在中性或碱性条件中是稳定的,但酸化后能氧化KI,生成I2和NO气体。(1)亚硝酸分解的化学方程式是 _____________________(2)酸性溶液中亚硝酸钠和碘化钾反应制取NO的离子方程式是 __________________。(3)在隔绝空气条件下,按下列操作制取NO:先取亚硝酸钠溶液适量加入稀盐酸片刻后,再加入KI溶液,试问这样的气体是否纯净? 为什么? ____________________________________________________________。
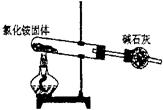
20.(12分)用图所示装置(酒精灯、铁架台等未画出)制取三氯化磷,在曲颈甑d中放入足量白磷,将氯气迅速而又不间断地通入曲颈甑中,氯气与白磷就会发生反应,产生火焰,三氯化磷和五氯化磷的物理常数如下:
| 熔点 | 沸点 | |
| 三氯化磷 | -112℃ | 76℃ |
| 五氯化磷 | 148℃ | 200℃分解 |
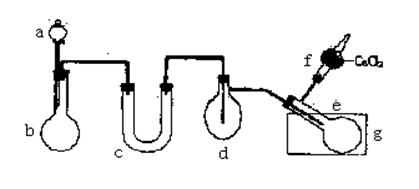
(1)有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a、b中应该装入的试剂分别是:a___________,b__________.
(2)__________仪器需要加热(填仪器对应的字母)
(3)在蒸馏烧瓶e中收集生成三氯化磷.应在水槽g中加入___________。
(4)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及装入其中的物质都不能含有水分,为除去氯气中的水分,c可以装入下列物质中的(填字母)_________.
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)实验室的白磷保存于 中;干燥管f中盛放的是无水氯化钙其作用是
(6)该装置有一个最大的缺点是
21.(6分)牙齿表面由一层硬的,组成为Ca5(PO4)3OH(固)的物质保护着,它在唾液中存在下列平衡Ca5(PO4)3OH(固)![]() 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是________________________________________________________________
(2)已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。当牙膏中配有氟化物添加剂后能防止龋齿的原因是__________________________ ___________
(3)根据以上原理,请你提出一种日常生活中其它促进牙齿矿化的方法,答:_________________。
22.(8分)某种常见的白色晶体A,与盐酸以应产生无刺激性气味的气体B;将B通入澄清石灰水,石灰水变浑浊.若在A的水溶液中加氢氧化钡溶液,则析出白色沉淀C和无色气体D;D可以使湿润的红色石蕊试纸变蓝.加热固体A,可生成水、B和D,而且B和D的物质的量之比为1 :1 ,根据以上事实,可以判断出A是________,B是_________,C是__________.加热固体A生成水、B和D的化学方程式是________ __________________.
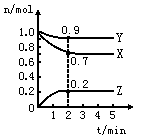 23.(12分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
23.(12分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为_________ ___
(2)反应开始至2min,气体Z的平均反应速率为____________。
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的____________倍;
②若此时只将容器的体积扩大为原来的2倍,
达新平衡时,容器内温度将降低(容器不与外界
进行热交换),则该反应为____________反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时____________(填增大、减小或相等)。
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是____________。
24.(12分)利用天然气合成氨的工艺流程示意如下:
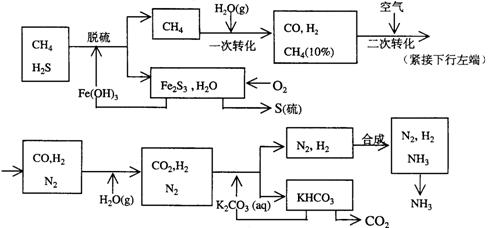
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于
(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
四、计算题:
25.(8分)2.24克铁与100mL稀硝酸混合后充分反应,还原产物只有NO,并且铁、硝酸均无剩余。向反应后溶液中加入50mL0.2 ![]() 的KI溶液,恰好将溶液中的Fe3+全部还原。已知:
的KI溶液,恰好将溶液中的Fe3+全部还原。已知:
2Fe3++2I-=2 Fe2++I2
(1)求反应后溶液中Fe3+和Fe2+的物质的量。
(2)求原硝酸溶液的物质的量浓度。
26.(12分)
I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)![]() C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
(27、28题教改班学生必做,普通班学生不做)(8分)
27.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是
A 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B 甲烧杯中的酸过量
C 两烧杯中参加反应的锌等量
D 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
28.现有下列各坐标图:
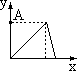
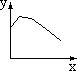
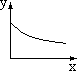
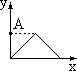

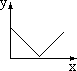
A B C D E F
(1)x轴坐标代表加水量,y轴代表[H+],能表示出0.1mol/L醋酸在稀释时的状况的坐标图是 ;
(2)x轴代表在搅拌情况下向铝盐溶液中加入NaOH物质的量的多少,y轴代表混和物中沉淀量的变化,那么该坐标图应是 ;
(3)x轴代表向1升0.01mol/L石灰水中通入CO2的质量(克),y轴代表沉淀质量(克)的变化,符合这一情况的坐标图是
(4)x轴代表在氢氧化钡溶液中滴加硫酸的量,y轴代表溶液导电性的变化,符合这一关系的坐标图是 。
第一学期
高二年级化学阶段测试答案卷
一、二、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| |||||||||
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三、填空
19.(7分)(1)亚硝酸分解的化学方程式是 ______________ _______
(2)制取NO的离子方程式是 _______ _________
(3)是否纯净? 为什么? ______________________________________________。
20. (12分)(1)a___________,b__________.
(2)__________ (3)g中加入___________。
(4)c可以装入下列物质中的(填字母)_________.
(5)实验室的白磷保存于 中; f的作用是
(6)缺点是
21.(6分)(1)________________________________________________________________
(2)_____________________ _____ ___________
(3)______ __________。
22.(8分)A是 ________ B是 _______ __ C是 _________ _.
加热固体A的化学方程式是________ __________________ .
23.(12分)
(1)化学方程式为____ _____ ___(2)反应速率为____________。
(3)①____________倍;
②该反应为____________反应,平均分子量比原平衡时____________(填增大、减小或相等)。
(4)X的聚集状态是____________。
24(12分)(1)脱硫时的化学方程式
(2)产生H2 mol(用含n的代数式表示) (3)加压的理论依据是 (多选扣分)
(4)
(写出CO2的一种重要用途)。
(5)第三处循环(循环方向、循环物质)。
四、计算
25.(9分)
26.(12分)I.(1) mol。 (2) mol。
(3)x= mol, y= mol。
平衡时,B的物质的量 (选填一个编号)
理由是 。
(4)C的物质的量分数是 。
II.比较 (选填一个编号)。
判断的理由是 。
(此2题非教改班学生不做)
27.
28.(1) (2)
(3) (4)
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| C | A | C | C | B | B | C | C |
| |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| AC | B | B | C | C | AD | B | AC | B | AC |
19、![]() ,
,![]()
不能,因为![]() ,亚硝酸分解生成NO2。
,亚硝酸分解生成NO2。
20.(1)浓盐酸,MnO2 (2)b (3)冷水 (4)C
(5)水; 防止空气中水蒸气进入与PCl3作用 (6)没有尾气吸收装置
21.(1)酸消耗OH-使平衡正向移动,Ca5(PO4)3OH溶解
(2)在F-离子作用下Ca5(PO4)3OH转变为更难溶的Ca5(PO4)3F能防止龋齿或以离子方程式表示
Ca5(PO4)3OH+ F-=Ca5(PO4)3F+ OH-
22.NH4HCO3 CO2 BaCO3 NH4HCO3=NH3+H2O+CO2
23.(1)3X+Y![]() 2Z (2)0.05mol·L-1·min-1
2Z (2)0.05mol·L-1·min-1
(3)①0.9 ②放热 减小
(4)液或固态
24. (1)3H2S+2Fe(OH)3→Fe2S3+6H2O(2分)
(2)27n(3分)
(3)b(3分)
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)(2分)
(5)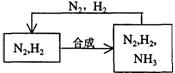 (2分)
(2分)
25.(1) Fe3+:0.01mol Fe2+:0.03mol
(2) 1.2mol/L
26.(1)(1-a) (2)3a (3)2 3-3a 丁
若3a>1,B的物质的量小于2mol;若![]() ,B的物质的量等于2mol;
,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol
(4)![]()
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
27.AC
28.(1)C (2)A (3)D (4)F