高二化学联考试题(理科)
(本卷满分120,时间60分钟)
一、选择题(只有一个正确选项,每小题6分,共60分)
1.下列现象的产生与人为排放大气污染物氮氧化物无关的是 ( )
A.闪电 B.光化学烟雾 C.酸雨D.臭氧层空洞
2.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重元素,该元素原子核内中子数与核外电子数之差是 ( )
A.57 B.47 C.61 D.293
3.下列化合物中阳离子半径与阴离子半径比值最小的是 ( )
A.NaF B.MgI2 C.BaI2 D.KBr
4.2gAO32-中核外电子数比质子数多0.05NA(NA代表阿伏加德罗常数)个,则元素A的相对原子质量为 ( )
A.12 B.32 C.60 D.80
5.在一密闭容器中,反应aA(g)=bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来65%,则 ( )
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
6.在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是 ( )
A.c(Na+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) B.c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C.c(Na+)﹥c(CH3COO-)﹥c(H+)﹥c(OH-) D.c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
7.将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得c(SO42—)=
0.105mol·L-1、c(Al3+)=0.055mol·L-1,溶液的pH=2.0(假设溶液中硫酸完全电离为H+和
SO42—),则c(K+)为 ( )
A.0.045mol·L-1 B.0.035mol·L-1 C.0.055mol·L-1 D.0.040mol·L-1
8.在FeCl3和Fe2(SO4)3的混合溶液中,若不计Fe3+的水解,当溶液中c(Fe3+)=
c(SO![]() )
)
时,下列判断正确的是 ( )
A.c(Fe3+)>c(Cl-)
B.c(SO![]() )>c(Cl-)
)>c(Cl-)
C.c(SO![]() )<c(Cl-)
D.FeCl3和Fe2(SO4)3的物质的量相等
)<c(Cl-)
D.FeCl3和Fe2(SO4)3的物质的量相等
9.在一定条件下发生下列反应,其中属于盐类水解反应的是 ( )
A.NH4+ +2H2O ![]() NH3·H2O + H3O B.HS-+H+=== H2S
NH3·H2O + H3O B.HS-+H+=== H2S
C.Cl2+H2O ![]() H++Cl-+HClO D.HCO3- + H2O
H++Cl-+HClO D.HCO3- + H2O
![]() H3O+ + CO32-
H3O+ + CO32-
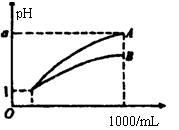 10.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是
( )
10.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是
( )
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
二.填空题(共25分)
11.(14分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2(二氟化氙)和KBrO3首先制得BrO4-,不久得到纯净KBrO4晶体。
(1)已知XeF2与水反应生成O2和氙气,氟则以化合态留在水溶液中,每生成1molO2,转移电子数 mol。该反应的氧化剂是 。
(2)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式是
(3)根据上面的信息,指出BrO4-的稳定性与pH的关系 。
12.(11分)已知:①A、B、C、D四种物质均含元素X,B和D还含有元素Y和Z,C还含有元素Z和W,A还含有元素Y。元素W、Z、Y、X的原子序数依次递增。W和Y同在一个主族,X和Z同在另一主族。②X在C中呈现它的最高化合价,在A中呈现它的最低化合价。③A、B、C三种物质在溶液中以物质的量之比2:1:3反应可得到物质的量之比为1:1:1的甲、乙、丙三种物质,甲就是X的单质。④C和D二种物质在溶液中反应,所得到的生成物中有一种是组成仅为X和Z的化合物。
请回答下列问题:
(1)元素X是 ,Z是 。
(2)写出③ 的反应的化学方程式: 。(3)写出④中反应的离子方程式: 。
三.实验题(共20分)
13.(6分)下面a~e是中学化学实验中常见的几种定量仪器:
a. 量筒、b. 容量瓶、c. 滴定管、d. 托盘天平、e. 温度计。
(1)其中标有“0”刻度,且“0”刻度在上方的仪器是 (填编号)。
(2)能够用以精确量取液体体积的是 (填写编号)。
(3)由于错误操作, 使得到的数据比正确数据偏小的是 (填写编号):
A. 用量筒量取液体时, 俯视液面读量取体积;
B.中和滴定达终点时,俯视液面读数,计算消耗溶液体积;
C.用容量瓶配制摩尔溶液, 定容时俯视液面所配得溶液浓度。
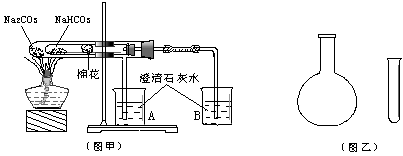 14.(14分)“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。下述两个实验均为“套管实验”,请观察实验装置、分析实验原理,并回答下列问题:
14.(14分)“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。下述两个实验均为“套管实验”,请观察实验装置、分析实验原理,并回答下列问题:
实验一:如图甲,小试管内塞有沾有无水硫酸铜粉末的棉花球。
(1) 从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有
。
(2)整个实验结束时,在操作上需要特别注意的问题是 。
实验二:在氨气的喷泉实验中,将圆底烧瓶集满氨气的操作很麻烦。请设计一个简单的操作方法,只用一支试管(如图乙),选用下列药品:A.氯化铵固体、B.氢氧化钠固体、C.浓氨水、D,浓硫酸、E.湿润的红色石蕊试纸,采用“套管法”在圆底烧瓶中集满喷泉实验用的氨气。
(3)所用的试剂为(填写番号): 。
(4)请简述所设计的操作及判断烧瓶集已满氨气的方法:
。
(5)将上述两个实验与普通实验相比较,“套管实验”明显具备的优点是:
。
四、计算题(共15分)
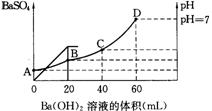 15. 往20mL硫酸和盐酸的混合液中,加入0.05mol/L Ba(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图,计算:
15. 往20mL硫酸和盐酸的混合液中,加入0.05mol/L Ba(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图,计算:
(1)最初混合溶液中H2SO4的物质的量浓度;
(2)最初混合溶液中HCl的物质的量浓度;
(3)B点时溶液的pH是多少?
答案:
1、A 2、A 3、B 4、B 5、C 6、A 7、B 8、D 9、A 10、A
11.(1)4;XeF2(6分) (2)XeF2+2OH-+BrO3-=Xe+2F+BrO4-+H2O(5分)
(3)pH越大,BrO4-越稳定(3分)
12.(11分)(1)S,O (2分)
(2)2Na2S+Na2SO3+3H2SO4=3S↓+3 Na2SO4+3H2O (5分)
(3)2H++S2O32-====SO2↑+S↓+H2O (4分)
13、(6分) (1) C (2分)。(2)C(2分)。(3)B(2分)。(4)②⑥(2分)。
14、(14分)(l)(4分)棉花球变蓝(1分);B中冒气泡且石灰水变浑(1分);刚开始时 A中有气泡产生(1分);小试管内有液滴出现(1分)。
(2)(1分)防止倒吸(或先撒导管后撤酒精灯)。(3)(2分)BC(E)(2分)。
(4)(6分)将圆底烧瓶倒置(1分),向试管中分先后加入试剂B、C(或先加入氢氧化钠固体,然后倒入一定的浓氯水)(1分),迅速将试管的上口伸至烧瓶的底部(1分),再将湿润的红色石蕊试纸置于烧瓶口处(1分),若试纸变蓝(1分),则说明烧瓶中NH3已集满(1分)。
(5)(1分)简化实验操作,提高实验效果,节约药品(答出其中一点即可)。
15(1)0.05mol/L (2)0.2mol/L (3)1 (各5分)