高二化学上学期期末考试2
(测试范围:第一章至第四章)
| 题 号 | 一 | 二 | 三 | 四 | 总 分 | |
| 分 数 | ||||||
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.试卷满分100分,考试时间
90分钟.
第Ⅰ卷 (选择题共46分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 |
可能用到的相对原子质量
K—39 C1—35.5 Ag—108 N一14 0—16 B1—80 Cu—64
一、选择题(本题包括8小题,每小题2分,共]6分。每小题只有一个选项是符合题意。)
1.欲迅速除去铝壶底的水垢,最好的方法是 ( )
(A)浓盐酸 (B)稀硝酸
(C)浓硫酸 (D)浓硝酸
2.把氨气通入稀盐酸里,使溶液的pH近似为7时,下列叙述正确的是 ( )
(A)溶液中NH3·H2O过量 (B)溶液中盐酸过量
(C)NH3和HCl恰好完全反应 (D)有难溶物生成
3.下列物质的溶液中,存在电离平衡的是 ( )
(A)Ca(OH)2 (B)CH3COOH
(C)BaS04 (D)CH3COONa
4.把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶掖中的金属离子 ( )
(A)是Fe3+和Cu2+ (B)是Fe2+和Cu2+
(C)是Fe2+和Fe3+ (D)只有Fe2+
5.(NH4)2PtCl6晶体受热完全分解,生成氮气、氯化氢气体、氯化铵和金属铂在此分解反中,
氧化产物与还原产物的物质的量之比是 ( )
(A)1:2 (B)1:3
(C)2:3 (D)3:2
6.下列各物质的颜色变化不是由平衡移动引起的是 ( )
(A)氯水在光照下颜色变浅 (B)NO2气体加热颜色变深
(C)H2、I2、HI平衡混合气体加压颜色变深 (D)饱和FeCl3溶液加热颜色变深
7.最近科学家冶炼出了纯度高达99.9999%的铁,你估计它不具有的性质是 ( )
(A)硬度比生铁低 (B)在潮湿的空气中放置不易生锈
 (C)与4mol/L盐酸的反应速率比生铁快 (D)在浓H2S04中可以钝化
(C)与4mol/L盐酸的反应速率比生铁快 (D)在浓H2S04中可以钝化
8.如图为装有活塞的密闭容器,内盛22.4mL一氧化氮。若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度
(A)等于1.369 g/L (B)等于2.054 g /L
(C)在1.369g/L和2.054g/L之间 (D)大于2.054g/L
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合若
正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正
确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.下列物质是电解质的有 ( )
(A)演化氢 (B)硫酸钡
(C)二氧化碳 (D)硝酸钾溶液
10.一定量的盐酸跟过量的镁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐
酸中加入适量的 ( )
(A)NaOH(固体) (B)K2SO4(溶液)
(C)Na2Co3(固体) (D)CH3COONa(固体)
11.与照明弹有关的反应原理是 ( )
(A)4Al+302![]() 2Al203
(B)2Mg+O2
2Al203
(B)2Mg+O2![]() 2Mg2O
2Mg2O
(C)2Al+3S![]() A12S3
(D)Mg+S
A12S3
(D)Mg+S![]() MgS
MgS
12.某碱性透明溶液中能大量共存的离子组是 ( )
(A)Si032-、OH-、K+、Na+ (B)K+、NH4+、S2-、Cl-
(C)Fe3+、Ca2+、SO![]() 、C1- (D)CO
、C1- (D)CO![]() 、A1O
、A1O![]() 、Na+、PO
、Na+、PO![]()
13.导致中和滴定实验结果偏高的原因是 ( )
(A)盛标准溶液的滴定管尖嘴部位有气泡,在滴定时气泡消失
(B)观察滴定液面高度时,滴定前仰视,滴定终了时又俯视
(C)取待测液的滴定管,用水洗后,未用待测液润洗
(D)滴定时用的锥形瓶中加入待测液后又加少量水稀释
14.Ph=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)
的关系如图(下图)所示,则下列说法中正确的是 ( )
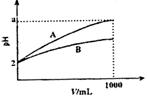 (A)A、B两种酸溶液物质的量浓度一定相等
(A)A、B两种酸溶液物质的量浓度一定相等
(B)稀释后A酸溶液的酸性一定比B酸溶液强
(C)a=5时,A是强酸,B是弱酸
(D)若A、B都是弱酸,5<a<2
15.当密闭容器中可逆反应:mA(气)+nB(固) pC(气)达到平衡
后,将容器的体积缩小,发现A的转化率也随之降低,下列表示各物质系数关系的式中, 适用于上述反应 ( )
(A)m+n>p (B)m+n<p
(C)m>p (D)m<P
16.下列说法正确的是 ( )
(A)相同温度下l mol/L氨水溶液与0.5mol/L氨水溶液中c(OH-)之比是2:1
(B)0.1 mol/L NH4Cl溶液中的c(NH![]() )=c(C1-)
)=c(C1-)
(C)向0.1 mol/L NaN03溶液中滴加稀盐酸,使溶液pH=5,此时混合液中的c(Na+)=c
(NO![]() )
)
(D)向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)=c
(CH3OO-)
17.中和相同体积、相同PH-的Ba(OH)2、NaOH和NH3·H20三种溶液,所用相同浓度的盐酸的
体积分别为Vl、V2、V3,则三者关系为 ( )
(A)V3>V2>V1, (B)V3=V2>V1
(C)V3>V2=V1 (D)V1=V2>V3
18.下列叙述中不正确的是 ( )
(A)金属的电化腐蚀比化学腐蚀普遍 (B)钢铁在干燥空气里不易腐烛
(C)用铝质铆钉铆接铁板,铁板易被腐蚀 (D)原电池中电子由正极流人负极
第Ⅱ卷 (非选择题 共54分)

三、填空题(本小题包括小题,共39分)
19.(9分)有一末知物可能由Ba(N03)2、NH4NO3、NH4Cl、(NH4)2S04中的一种或几种物质组成, 进行下列4个实验:
①未知物与热石灰混合研磨放出的气体能使润湿的红色石蕊试纸变蓝。
②未知物溶于水无沉淀。
③未知物溶液中加AgNO3溶液无沉淀生成。
④未知物和铜片、稀硫酸反应,先生成无色气体,而后变为红棕色,但无沉淀生成。
由此确定未知物是 。
实验①的化学方程式为 。
实验④的离子方程式为 。
20.(10分)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿PH试纸,然后用洁
净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是 (填“正确的”或“错误的”),其理由是
。
(2)如不正确,请分析是否一定有误差? 。
(3)若用此法分析测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是
,原因是 。
21.(10分)高炉炼铁中发生的基本反应之一为:FeO(固)+CO(气)![]() Fe(固)+CO2(气)(正反
Fe(固)+CO2(气)(正反
应为吸热反应),一定温度下,反应达到平衡时![]() 的值为一常数.用K表示。已知 1100℃时K=0.263。
的值为一常数.用K表示。已知 1100℃时K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO浓度的比值 。
平衡常数K值 。(本小题空格均备选:增大、减小或不变)
(2)1100°C时测得高炉中c(C02)=0.025mol/L,c(CO)=0.1 mol/L,在这种情况下,该反应
是否处于平衡状态 (填是或否),此时反应速率V正 V逆(填大于、
小于或等于)其原因是 。
22.(10分)(1)0.02mol/L的HCN溶液与0.02mol/LNaCN溶液等体积混合,已知该混合溶液中
c(Na+)>c(CN-),用“>、<、=”符号填空
①溶液中,c(OH-) c(H+) ②c(HCN) c(CN-)
③c(HCN)+c(CN-) 0.02mol/L
(2)①向明矾溶液中逐滴滴人氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液的pH
7(填>,、<、==,离子反应总方程式为 ;
②向明矾溶液中逐滴加氢氧化钠溶液至铝离子刚好沉淀完全时,溶液的PH
7(填>、<、=),离子反应总方程式为 。
 四、计算题(本题包括2小题,共15分)
四、计算题(本题包括2小题,共15分)
23.(本题满7分)
把9g铝镁合金投入40mL NaOH溶液中,测得反应产生的气体的体积为3.36L(标准况),加入足量盐酸后,残存的金属全部溶解,测得反应又产生6.72气体(标准状况)。试求:
(1)合金中镁的质量分数;
(2)原氢氧化钠溶液的物质的量浓度。

24.(本题满分8分)
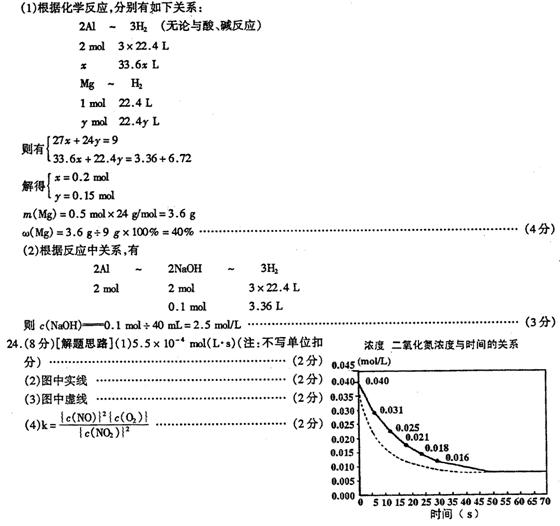
二氧化氮在加热条件下能够分解成一氧化氮和氧气。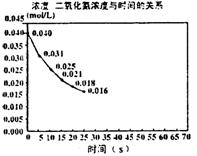
该反应进行到45秒时,达到平衡(N02浓度约为0.0125mol/L。右图中的曲线表示二氧化氮分解反应在前25秒内的反
应进程。
(1)请计算前20秒内氧气的平均生成速度:
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出催化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式:
上学期高二化学期末考试答案
(测试范围:第一章至第四章)
[命题意图]本试卷的命题意图是对第四章几种重要的金属进行评估检测,以达到及时评价教学效果的目的,为及时调整和改进教学方法提供依据。主要考查氮族元素、镁铝铁等几种重要的金属、原电池原理以及化学平衡、电离平衡等基本理论。考查学生对基础知识和基本理论的掌握情况。
[试卷点评]本试卷的特点是突出知识跨度较大,综合性较强。比较注重理论联系实际、注重对学生能力的考查。试卷难度中等,难易题比例合适。
[试卷答案]
1.(D) 2.(A) 3.(B) 4.(D) 5.(C) 6.(C) 7.(C) 8.(D) [解题思路]依据2NO+02:=2N02,NO和O2恰好反应生成NO2。
若只有NO2生成,在标准状况下密度为ρ=46/22.4=2.045(g/L),但在标准状况下,存在下列可逆反应:2NO2 ![]() N2O4,由
N2O4,由![]() ,
,
m一定,但V减小,故密度大于2.054g/L
[走出误区]在涉及到的NO2或吨N204有关量的计算问题,一般要考虑可逆反应2N02 ![]() N204的存在对有关量(气体物质的量、体积、密度、式量等)的影响。
N204的存在对有关量(气体物质的量、体积、密度、式量等)的影响。
9.(A)(B) 10.(B)(D) 11.(B) 12.(A)(D) 13.(A) 14.(C)(D) 15.(D) 16.(C)(D) [解题思路]选项
(A)中两氨水溶液的浓度比是2:1,但氨水是弱碱,不同浓度时,电离度不同,所以其水溶液中c(OH-)之比并不等于2:1。选项(B)中NH4Cl是由弱碱强酸所生成的盐,在水溶液中Cl-离子不发生水解。而NH![]()
![]() 离子要水解:NH
离子要水解:NH![]() +H20
+H20 ![]() NH3·H20+H+,这样就消耗了部分NH
NH3·H20+H+,这样就消耗了部分NH![]() 离子,所以在0.1 mol/L NH4Cl溶液中c(NH
离子,所以在0.1 mol/L NH4Cl溶液中c(NH![]() )<c(Cl-)。选项(C)中的NAN03是强酸强碱所生成的盐。它不发生水解,所以0.1mol/L NaNO3溶液中,不管溶液pH是多少,它都是满足c(Na+)=c(NO
)<c(Cl-)。选项(C)中的NAN03是强酸强碱所生成的盐。它不发生水解,所以0.1mol/L NaNO3溶液中,不管溶液pH是多少,它都是满足c(Na+)=c(NO![]() ),即此选项正确。选项(D)中,若只是单纯的醋酸钠溶液,则由于CH3COO-离子部分水解,使溶液中c(Na+)>c(CH3COO-)。现在已经向溶液中加入适量醋酸,由于醋酸电离,CH3COOH
),即此选项正确。选项(D)中,若只是单纯的醋酸钠溶液,则由于CH3COO-离子部分水解,使溶液中c(Na+)>c(CH3COO-)。现在已经向溶液中加入适量醋酸,由于醋酸电离,CH3COOH![]() H++CH3COO-,又补充了醋酸根离子。混合液中由于整个溶液是电中性的,即溶液中所有阳离子正电荷之和必等于所有阴离子的负电荷之和,即:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)。在pH=7时,c(H+)=c(OH-),所以c(Na+)=c(CH3COO-),故(D)项正确。 17.(C) 18.(C)(D)
H++CH3COO-,又补充了醋酸根离子。混合液中由于整个溶液是电中性的,即溶液中所有阳离子正电荷之和必等于所有阴离子的负电荷之和,即:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)。在pH=7时,c(H+)=c(OH-),所以c(Na+)=c(CH3COO-),故(D)项正确。 17.(C) 18.(C)(D)
19.(9分)NH4NO3,
2NH4NO3+Ca(OH)2![]() 2NH3↑+2H20+Ca(N03)2:
2NH3↑+2H20+Ca(N03)2:
3Cu+8H++2NO![]() ═3Cu2++2NO↑+4H20 (每线3分)
═3Cu2++2NO↑+4H20 (每线3分)
20.(10分)(1)不正确(2分);若溶液不显中性,则H+或OH-被稀释,测出的不为溶液中H+或OH-对应的Ph。
(2分)(2)不一定有误差,当溶液为中性时不产生误差。(2分)(3)测得的盐酸的pH误差较大;(2分)
因为在稀释过程中醋酸继续电离产生H+,使得溶液中c(H+)较盐酸溶液中c(H+)大,误差较小。(2分)
21.(1)增大(2分) 增大(2分) (2)否(2分) 大于(2分) 此时c(CO2)[]c(CO)=0.25<0.263,说明反应不处于平衡状态,且平衡应向正反应方向移动,故V正大于V逆(2分)
22.(10分)(1)①> ②> ③=
(2)①>;Al3++2SO![]() +2Ba2++40H-=2BaSO4↓+A10
+2Ba2++40H-=2BaSO4↓+A10![]() +2H20
+2H20
②=;2Al3++3SO![]() +3B2++60H-=3BaS04↓+2Al(OH)3↓
+3B2++60H-=3BaS04↓+2Al(OH)3↓
 23.(7分)[解题思路]设此合金中有Alxmol,Mgy mol
23.(7分)[解题思路]设此合金中有Alxmol,Mgy mol