高二化学上学期期末试题
命题人:WGA
甲卷
第Ⅰ卷 选择题(共60分)
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64 Zn:65
一、选择题(本题包括5小题,每小题只有一个正确答案,每小题3分共15分)
1、金属具有优良的导热性,原因是
A.金属受热时易熔化为液态,液体易流动,传热性能好
B.金属离子有优良的导热性能
C.热量易在金属内部形成对流
D.自由电子受热时能量增加,运动速度加快,通过碰撞将能量传递给其它金属离子或电子
2、利用铝合金代替铝配制钥匙是利用铝合金的
A.熔点低 B.不易锈蚀
C.硬度大 D.密度小,便于携带
3、金属的下列性质中和金属晶体无关的是
A 良好的导电性 B 反应中易失电子
C 良好的延展性 D 良好的导热性
4、目前已经发现和通过人工合成的有机物有一千多万种。有机物种类繁多的主要原因是:
A.碳元素可以与许多其它元素结合而形成化合物
B.有机物不但存在于动植物体内,而且可以通过人工的方法合成
C.碳元素在自然界中的含量丰富,故形成化合物的种类多
D.碳原子含有4个价电子,可以跟其它原子形成4个共价健,也可以在碳原子间形成共价键,从而形成长的碳链
5、下列物质中,不能用单质直接制取的是:
A FeCl3 B CuS
C FeS D Fe3O4
二、选择题(每小题有一个或二个正确答案,每小题4分共40分。半对2分,有错无分)
6、下列烷烃的一氯代物没有同分异构体的是:
A 2,2-二甲基丙烷 B 丙烷
C 丁烷 D 乙烷
7、下列叙述中错误的是:
A.点燃甲烷不必象点燃氢气那样事先验纯
B.甲烷燃烧能放出大量的热,所以是一种很好的气体燃料
C.煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生
D.如果隔绝空气,将甲烷加热到1000℃以上,能分解成炭黑和氢气
8、下列物质:①H2O ②CCl4 ③CH4 ④NH3 ⑤C2H6 ⑥CO2,分子具有正四面体型的是
A.②③ B.③④⑤
C.①③⑥ D.全部
9、下列反应的离子方程式正确的是
A、澄清的石灰水与碳酸氢钙溶液混合:Ca2+ + HCO3— + OH—=CaCO3 ↓+ H2O
B、向次氯酸钙溶液中通入二氧化硫: Ca2+ + 2ClO—+ SO2 + H2O = CaSO3↓+ 2HClO
C、硫化亚铁中加入盐酸: S2— + 2H+ = H2S↑
D、钠和冷水反应: Na+2H2O = Na+ + H2↑+2OH—
10、下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是
A、Na+ Ba2+ Cl— SO42— B、H+ NH4+ Al3+ SO42-
C、K+ AlO2— NO3— OH— D、H+ Cl— CH3COO— NO3—
11、同系物具有:①相同的通式;②相同的最简式;③相同的物理性质;④相似的化学性质
A.①②④ B.①④
C.③④ D.②③
![]() 12、CH3H2C CH3CH2—CH2CH(CH3)2
12、CH3H2C CH3CH2—CH2CH(CH3)2
CH3—C—C—CH—CH2—CH2—CH3 该物质中主链上的碳原子个数是
CH3 CH2—C(CH3)3
A.7 B.8 C.9 D.12
13、下列叙述正确的是:
A、含金属元素的离子不一定是阳离子,全由非金属元素也可形成阳离子
B、在氧化—还原反应中,非金属单质一定是氧化剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
14、下列各反应的化学方程式中,属于水解反应的是:
A H2O+H2O![]() H3O++OH—
B HCO3—+OH—
H3O++OH—
B HCO3—+OH—![]() H2O+CO32—
H2O+CO32—
C CO2+H2O![]() H2CO3
D Cl2+H2O
H2CO3
D Cl2+H2O![]() H+ + Cl—+HClO
H+ + Cl—+HClO
15、对于达到平衡状态的可逆反应:N2(g)+3H2(g)![]() 2NH3(g)+Q,下列叙述正确的是:
2NH3(g)+Q,下列叙述正确的是:
A 反应物和生成物的浓度相等 B N2和H2的浓度之比一定为1:3
C 降低温度,平衡混合物里NH3的浓度增大 D 增大压强,不利于氨的合成
三、填空、实验题(本题包括5小题,共31分)
16、(6分)衣服上沾有动、植物油污,用水洗不掉,但可用汽油洗去,这是因为大多数有机物难 ________而易 ______。有机化工厂附近严禁火种,这是因为绝大多数有机物_________。
17、(6分)冶炼金属常用以下几种方法:①以C或CO、H2作还原剂还原 ②电解法 ③热分解法。现冶炼下列金属,试标明适宜的冶炼方法(填序号):
Al Fe Na____________
18.(2+3=5分)配制硫酸铁溶液常出现浑浊现象,其原因是 ________,如何操作既可得到透明溶液而又不引进杂质离子 ____ 。
19、(6分)分别除去下列各种物质中的少量杂质,写出所用试剂的化学式:
| 物质 | 杂质 | 除杂试剂 |
| MgCl2 | MgCO3 | |
| FeCl2 | Cu2+ | |
| Fe | Al |
20.(8分) ①在氯化铝溶液中加入少量的氢氧化钠溶液,可观察到现象:_____________ , ②在氢氧化钠溶液中加入过量的氯化铝溶液并不断震荡,可观察到现象: ___________________ , 写出①的化学方程式:____________________,写出②中总的离子方程式____________.
四、计算题
21、(14分) 完全中和10.2g某二元酸H2A时,消耗了24g NaOH。求:
(1)该二元酸的摩尔质量是___34g/mol_____;
(2)A的相对原子质量是_____32_________;
(3)已知A的原子核中质子数与中子数相等,A是___S__元素,该酸的电离方程式为:_________,其酸性主要是由 第一步电离 决定的,对应的平衡常数表达式Ka=______________。
(4)该酸溶液能与FeCl3 溶液反应,离子方程式为:_________________________。
乙卷
五、选择题(每小题4分共24分,每小题有一或二个正确答案,半对2分,有错无分)
22、下列物质中,不能通过化合反应生成的是:①FeCl2 ②Fe(OH)3 ③NO2 ④HNO3 ⑤CHCl3 ⑥Mg(OH)2
A、只有一种 B、不多于三种 C、多于三种 D、无法判断
23、在金属晶体中,如果金属原子的价电子数越多,原子半径越小,金属的熔沸点越高,则下列各组金属熔沸点高低顺序正确的是
A、Mg>Al>Ca B、Al>Li >Na
C、Al>Mg>Ca D、Mg>Ba>Al
24、A、B、C都是金属,把A放入C的盐溶液中,A的表面附着一层C;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序是:
A、 A>B>C B、 A>C>B
C、 B>A>C D、 B>C>A
25、只用一种试剂即可区别Na2SO4、MgSO4、AlCl3、NH4HCO3、CuSO4、FeCl3 几种溶液,这种试剂是
A、 HCl B、 BaCl2
C、 AgNO3 D、 NaOH
26、用一定物质的量浓度的NaOH溶液,使物质的量浓度和体积均相同的FeSO4、Fe2(SO4)3溶液中的Fe2+、Fe3+完全沉淀,则所消耗的NaOH的体积之比为:
A、1:3 B、2:3
C、1:6 D、1:2
六、填空题、实验题(本题包括2小题,共14分)
27、(6分)现有①CH4、②C2H6、③C3H8、④CO四种物质。等质量的以上物质中,在相同状况下体积最大的是 ① 、燃烧时生成二氧化碳最少的是 ④ 。同状况同体积的以上五种物质完全燃烧时消耗氧气最多的是 ③ (填序号)
28、(8分)按要求写出下列反应的化学方程式及指出相应的反应类型:
| 要求 | 化学方程式(写主要反应) | 反应类型 |
| 甲烷和氯气混合光照 | ||
| 乙烯通入溴水 |
七、计算题(12分)
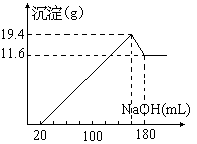
29、将一定质量的镁铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得的溶液中滴加5mol/L NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液体积关系如图:
 求:
求:
(1)原合金中Mg、Al质量各多少?
解:
(2)盐酸的物质的量浓度。
高二上学期期末考试答案
一、选择题:(2分/题,共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | B | B | D | B | AD | A | A | A | C |
| 11 | 12 | 13 | 14 | 15 |
| ||||
| B | C | AD | B | C |
| ||||
三、四、填空题(共13分)
16、(各2分共6分) 难溶于水;易溶于有机溶剂;易燃烧
17、(各2分共6分) ② ① ②
18. Fe3+发生水解生成Fe(OH)3;将硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需浓度.
19、HCl;Fe;NaOH
20. 有白色沉淀生成;开始没有白色沉淀生成,一段时间后开始有白色沉淀生成并逐渐增多,直至不再增加;AlCl3+3NaOH=Al(OH)3+3NaCl; Al3+ + 4OH—=AlO2—+2H2O
五、
21、(14分)
(1)___34g/mol_____; (2)_____32_________;
![]()
![]() (3) S ; H2S
H++HS—、 HS—
H++S2—; 第一步电离 ;
(3) S ; H2S
H++HS—、 HS—
H++S2—; 第一步电离 ;
![]()
(4)H2S + 2Fe3+ = 2Fe2+ + 2H+ + S↓。
乙卷
| 题号 | 22 | 23 | 24 | 25 | 26 |
| 答案 | A | BC | C | D | A |
27、①;④;③
28、略
29、(1)解:
2Al+6HCl = 2AlCl3+3H2↑;
Mg+2HCl=MgCl2+H2 ↑ ;
AlCl3+3NaOH=Al(OH)3↓+3NaCl ;
Al(OH)3+NaOH = NaAlO2+2H2O。……………………2
由图知:Mg(OH)2 的质量为11.6g,即0.2mol,……3
所以m(Mg)=24g/mol ×0.2mol =4.8g;………………5
溶解Al(OH)3消耗的NaOH为(180-160)mL ×1×10—3 L×5 mol/L = 0.1 mol,即Al(OH)3的物质的量为0.1mol,………………………………………………6
所以m(Al)=0.1 mol×27 g/mol =2.7g。………………8
(2)
解:由反应知,当沉淀量最大时,HCl、NaOH 正好中和,所以n(HCl)=0.16 L×5 mol/L = 0.8 mol ,c(HCl)= n / V = 0.8mol / 0.1L = 8mol/L。……12