第一学期期末考试
高二化学试题(化学班用)
(命题 黎婉君 审题 卢 成)
原子量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 Fe 56
第一卷(选择题 共60分)
一、选择题(本题共包括8小题,每小题只有一个正确答案,每小题4分共32分)
1、下列各组物质中,互为同素异形体的是( )
A、氯水和液氯 B、氧气和臭氧 C、白磷和黄磷 D、12C和13C
2、常温下能用铁制容器盛放的是( )
A、浓盐酸 B、浓硝酸 C、稀盐酸 D、稀硝酸
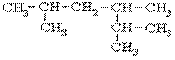 3、结构式为 的化合物的正确命名是( )
3、结构式为 的化合物的正确命名是( )
A、2-甲基4-异丙基已烷 B、2,4,5-三甲基已烷
C、新壬烷 D、2,3,5-三甲基已烷
4、a g Na和Al的混合物,加入到b g水中,待反应停止后,经测定生成的沉淀为c g,则滤液中的溶质是( )
A、NaOH B、NaOH和NaAlO2 C、 NaAlO2 D、 无法判断
5、对镁、铝叙述不正确的是( )
A、在化学反应中,Al比Mg失电子多,所以Al的还原性比Mg强
B、Mg可与NH4Cl溶液反应产生H2,Al则不能与NH4Cl溶液反应放出H2
C、铝的熔沸点比镁高,硬度比镁大,是因为铝中微粒间作用比镁强
D、铝可与NaOH溶液反应,而镁不能
6、体积相同、pH相同的HCl溶液和CH3COOH溶液,与足量NaOH溶液中和时,两者消耗NaOH的物质的量( )
A、相同 B、HCl多 C、CH3COOH多 D、无法比较
7、下列各组物质中,前一种与后二种物质反应后不能产生同一种气体的是( )
A、 Al、NaOH溶液、盐酸 B、 (NH4)2S、NaOH溶液、盐酸
C、 H2O、Na2O2、F2 D、 NaHCO3、NaHSO4溶液、盐酸
8、分子式为C5H12O的饱和一元醇,其分子中含有两个-CH3,两个-CH2-,一个![]() 和一个-OH,它的可能结构有( )
和一个-OH,它的可能结构有( )
A、2种 B、3种 C、4种 D、5种
二、选择题(本题共包括7小题,每小题有1—2个正确答案,每小题4分共28分)
9、某烃分子中有一个环状结构和两个双键,它的分子式可能是( )
A、C4H6 B、C7H8 C、C5H6 D、C10H8
![]()
10、描述分子结构的下列叙述中,正确的是( )
A、除苯环外的其余碳原子有可能都在同一直线上
B、除苯环外的其余碳原子不可能都在同一直线上
C、12个碳原子不可能都在同一平面上
D、12个碳原子有可能都在同一平面上
11、有A、B两种烃,含碳的质量分数相同,关于A和B叙述中正确的是( )
A、二者最简式相同 B、二者一定是同分异构体
C、二者不可能是同系物 D、各1mol的A和B分别燃烧生成CO2的质量一定相等
12、下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是( )
A、Ca2+、Cl-、MnO4-、Na+ B、 K+、Cl-、SO42-、NH4+
C、 AlO2-、Na+、Al3+、I- D、 H+、Cl-、Ba2+、NO3-
13、将10ml0.1mol/L氨水与12ml0.1mol/L盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是( )
A、c(Cl—)>c(NH4+)>c(H+)>c(OH—)
B、c(Cl—)>c(NH4+)>c(OH—)>c(H+)
C、c(H+)>c(OH—)>c(Cl—)>c(NH4+)
D、c(H+)>c(Cl—)>c(NH4+)>c(OH—)
14、A、B、C三种醇同足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,则A、B、C三种醇分子中羟基数之比是( )
A、3:2:1 B、2:6:3 C、3:6:2 D、2:1:3
15、在20℃时,某气态烃与O2的混合气在密闭的容器中点燃爆炸后又恢复到20℃,此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎成真空,此烃的分子式可能是( )
A、CH4 B、C2H4 C、C2H6 D、C3H8
南海一中2002-2003学年度第一学期期末考试
高二化学试题
(化学班用)
第二卷(非选择题 共90分)
姓名___________班别______学号_________成绩_______
三、 填空题
16、(8分)写出下列微粒的电子式:
羟基_____________ 氢氧根____________ 乙醇_________________ 甲基______________
17、(14分)在25°C时,纯水中C(H+)·C(OH-)=_________________;
在NH4Cl溶液中C(H+)_____10-7mol/L(大于、小于或等于)pH_____7(大于、小于或等于);
在Na2CO3溶液中C(H+)_____10-7mol/L (大于、小于或等于) pH_____7(大于、小于或等于)
在NaCl溶液中C(H+)_____10-7mol/L (大于、小于或等于) pH_____7(大于、小于或等于);
18、(8分)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn+2OH—=ZnO+H2O+2e— Ag2O+H2O+2e—=2Ag+2OH—
电池的负极是______________,正极发生的是_______________反应(反应类型),
总反应式为______________________________________________________________
四、推断题:
19、(10分)某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
| ||||
![]()
![]()
![]()
 | |||||||
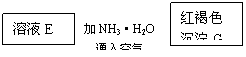 | |||||||
|
![]()
|
|
|
|
|
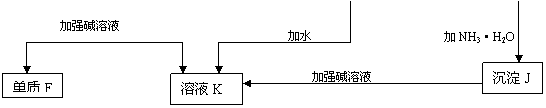 | |||||
(1)单质F是_____________
(2)写出由E生成G的离子反应方程式__________________________________________
(3)溶液M中所含金属离子是_____________
![]() (4)由C E+F的反应中,稀酸I能否改用浓硝酸,为什么?
(4)由C E+F的反应中,稀酸I能否改用浓硝酸,为什么?
___________________________________________________________________________
___________________________________________________________________________
20、(12分)在金属锂和CuI存在的条件下,卤代烃之间可发生反应,生成一种烃。如:
|
|
|
![]()
![]()
![]() C4H9Cl C4H9Li (C4H9)2CuLi
C4H9-C2H5
C4H9Cl C4H9Li (C4H9)2CuLi
C4H9-C2H5
试将下列各步变化中各有机物的结构简式填入空白处:
|
![]()
![]()
|
|
|
![]()
![]() 苯 D
苯 D
A_____________________B_____________________C______________________
D_____________________E_____________________F______________________
五、实验题
21、(2分)下列盛放物质的方法正确的是_______________________
A、 把汽油存放在带橡皮塞的玻璃瓶中
B、 把硝酸银溶液保存在棕色玻璃瓶中
C、 把氢氟酸存放在带木塞的玻璃瓶中
D、把固体氢氧化钠保存在塑料瓶中
E、 把金属钠存放在无水乙醇中
22、(16分)草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验:
①称取Wg草酸晶体配成100.00ml水溶液;
![]() ②取25.00ml所配的草酸溶液置于锥形瓶中,加适量的稀硫酸,用浓度为amol/L的KMnO4溶液滴定,所发生的反应为:
②取25.00ml所配的草酸溶液置于锥形瓶中,加适量的稀硫酸,用浓度为amol/L的KMnO4溶液滴定,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+ 10CO2 +2MnSO4+8H2O
反应生成的MnSO4在水溶液中基本无色。试回答下列问题:
(1) 为保证实验的精确度,实验①中,应从下列仪器中选取的一组仪器是_____________
A、托盘天平(含砝码、镊子) B、50ml酸式滴定管 C、100ml量筒
D、100ml容量瓶 E、烧杯 F、胶头滴管 G、锥形瓶 H、玻璃棒
I、药匙 J、50ml碱式滴定管
(2) 实验②中,滴定时KMnO4溶液应装在__________式滴定管中
(3) 达到滴定终点的标志是___________________________________________________
(4) 若实验过程中,用少量蒸馏水冲洗锥形瓶内壁,再连续滴定,则所测定的x值______(偏大、偏小或无影响)
(5) 若滴定过程中,共用去amol/LKMnO4溶液Vml,则所配制的草酸溶液的物质的量浓度
为________________________,由此可计算出草酸晶体中的x值为_____________________
23、(14分)1,2-二溴乙烷可作抗爆剂的添加剂,常温上它是无色液体,密度2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下图所示设备制备1,2-二溴乙烷。图中分液漏斗和烧瓶a中装有乙醇和浓H2SO4的混合液,试管d 中装有液溴
(表面覆盖少量水)。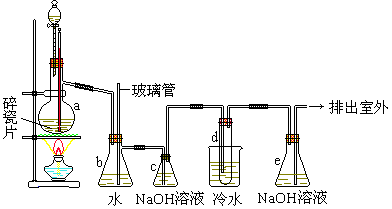
填写下列空白:
①写出本题中制备1,2-二溴乙烷的两个化学反应方程式:
____________________________________,_____________________________________。
②安全瓶b可以防止倒吸,并可检查实验进行时试管d是否发生堵塞,请写出发生堵塞时
瓶b中的现象
______________________________________________________________。
③容器c中的NaOH溶液的作用是:_____________________________________________。
④某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果气密性没有问题,试分析其可能的原因。
六、计算题
24、(6分)1mol/L AlCl3溶液75mL与2mol/LNaOH溶液120mL混合,可得到Al(OH)3沉淀多少克?
第一学期期末考试
双向细目表
高二化学班
| 内容 | 识记 | 理解 | 应用 | 分值 |
| 氮和磷 | √ | √ | 4 | |
| 氨 铵盐 | √ | √ | 4 | |
| 硝酸 | √ | √ | 8 | |
| 氧化还原反应方程式的配平 | √ | 6 | ||
| 化学方程式的计算 | √ | 8 | ||
| 化学反应速率 | √ | 4 | ||
| 化学平衡 | √ | √ | 6 | |
| 影响化学平衡的条件 | √ | 4 | ||
| 合成氨条件的选择 | √ | 4 | ||
| 电离平衡 | √ | √ | 8 | |
| 水的电离和溶液的pH | √ | √ | 8 | |
| 盐类的水解 | √ | 8 | ||
| 酸碱中和滴定 | √ | 4 | ||
| 镁和铝 | √ | √ | 8 | |
| 铁和铁的化合物 | √ | √ | 8 | |
| 金属的冶炼 | ||||
| 原电池原理及其应用 | √ | √ | 10 | |
| 甲烷 | √ | √ | 8 | |
| 烷烃 | √ | √ | 4 | |
| 乙烯 烯烃 | √ | √ | √ | 8 |
| 乙炔 炔烃 | √ | √ | √ | 8 |
| 苯 芳香烃 | √ | √ | √ | 8 |
| 石油 煤 | ||||
| 溴乙烷 卤代烃 | √ | 4 | ||
| 乙醇 醇类 | √ | √ | √ | 8 |
第一学期期末考试
高二化学试题
(化学班用)
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | B | B | D | C | A | C | B | C | C | BD | A | BD | A | D | BD |
16、
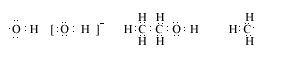 (各2分共8分)
(各2分共8分)
17、1X10-14、>、<、<、>、=、= (各2分共14分)
18、Zn(2分)、还原(2分)、Zn+Ag2O=ZnO+2Ag(4分)
19、(1)H2 (2分)
(2)4Fe2++8NH3·H2O+O2+2H2O=4Fe(OH)3 +8NH4+ (4分)
或Fe2+ +2 NH3·H2O=Fe(OH)2+2NH4+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Al3+和Na+ (2分)
(4)不能,因为铁在浓硝酸中会发生钝化 (2分)
![]() 20、CH≡CH、CH2═CHBr、(CH2═CH)2CuLi、C6H5Br、C6H5CH═CH2、
20、CH≡CH、CH2═CHBr、(CH2═CH)2CuLi、C6H5Br、C6H5CH═CH2、
![]() ——CH(C6H5)—CH2 —n
(各2分共14分)
——CH(C6H5)—CH2 —n
(各2分共14分)
21、BD(2分)
22、(1)A、 D、E、F、 H、I (2分)
(2)酸(2分)
(3)紫红色褪去,再滴一滴,紫红色不褪色(或无气泡产生,再滴一滴,紫红色不褪色)
(2分)
(4)无影响(2分)
(5)0.1aVmol/L (4分) (50W-45aV)/9aV (4分)
23、
①CH3CH2OH![]() CH2=CH2↑+H2O(4分),
CH2=CH2↑+H2O(4分),
CH2=CH2+Br2→CH2Br-CH2Br(4分)
② b中水面会下降,玻璃管中的水柱会上升,甚至溢出 。(2分)
③ 除去CO2、SO2 、Br2。(2分)
④ 原因可能乙烯发生或通过液溴速度过快,也可能因控温不当产生的乙烯量少。(2分)
24、(6分)
n= 4n Al3+ — n OH-=4x1X0.075-2x0.012=0.06mol
m=0.06x78=4.68g