![]()
|
|
学科:化学 |
| 教学内容:高二化学金属的冶炼 |
【基础知识精讲】
1.金属的冶炼原理是将金属的化合物通过还原的方法使金属离子还原成金属单质.
由于金属的化学活动性不同,金属离子得到电子,还原成金属原子的能力也不同,所以采用不同的冶炼方法.
2.知识网络

3.方法导引
(1)熟练掌握金属活动性顺序表,注重该表在学习中的指导作用.如判断金属元素在自然界的存在形式,金属的还原性以及根据金属的还原性所采取的冶炼方法.
(2)锻炼自学能力,在教师的指导下自学教材内容,归纳金属冶炼的方法并应用到其它金属的冶炼.
【重点难点解析】
重点:工业上冶炼金属的一般方法:热分解法、热还原法、电解法.
难点:不同金属冶炼方法不同.如何选择合适的冶炼方法.
金属冶炼的本质是金属的离子从化合物中被还原成金属单质的过程.从金属活动顺序表可知,越活泼的金属,其阳离子的氧化性越弱;反之,越不活泼的金属,其阳离子的氧化性越强,因此不同的金属冶炼方法也不同.金属的位置越靠后,越容易被还原,用一般的还原方法就能使金属还原;金属的位置越靠前,越难被还原,最活泼的金属只能用最强的还原手段(电解)来还原.
【难题巧解点拨】
例1:某冶炼铝厂以碳棒为电极,电解熔融的三氧化二铝,当生成27kg铝时,阳极消耗12kg碳,则在阳极生成的CO2和CO二种气体的分子个数比为 .
分析 电解法炼铝的反应式为:
2Al2O3![]() 4Al
+ 3O2↑
4Al
+ 3O2↑
(阴极) (阳极)
在高温下,阳极产生的O2,易把石墨电极氧化为CO2和CO.
由题意:阴极产生的铝:![]() =1×103mol
=1×103mol
阳极消耗的碳:![]() =1×103mol
=1×103mol
而由方程式可算出阳极产生的O2为:
1×103×![]() =0.75×103mol.
=0.75×103mol.
阳极消耗的碳与产生的O2即反应生成CO和CO2.设生成的CO2为xmol,CO为ymol.则
![]()
解得 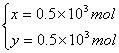 故生成CO2和CO的分子个数比为1∶1
故生成CO2和CO的分子个数比为1∶1
例2:为何工业上制镁时用电解MgCl2,而制铝时通常是电解Al2O3?
分析 作为工业生产,一要考虑原料来源、价格,二要考虑生产过程的能源消耗.MgCl2的溶点只有714℃,而MgO为2800℃,从能量消耗上来看显然用MgCl2优于MgO.MgCl2原料可从天然光卤石KCl·MgCl2·6H2O和海水中获得,所以工业上常采用在750℃左右电解无水MgCl2来制镁.而制铝的原料多来自铝土矿(主要成分为Al2O3),Al2O3的熔点也很高,为2045℃,但加入冰晶石(Na3AlF6)作熔剂,则可使Al2O3在962℃即熔化,而使铝得以大量生产.如果用电解AlCl3法,首先把铝土矿制成AlCl3要耗能及设备,且加热AlCl3时,AlCl3易气化,熔融态AlCl3未电离,不导电.
【命题趋势分析】
常考知识点:
1.金属冶炼的基本原理
2.金属冶炼方法的选择
3.金属冶炼的计算
4.金属冶炼过程的实验模拟.
【典型热点考题】
1.冶炼金属一般有下列四种方法:
①焦炭法;
②水煤气(或H2,CO)法;
③活泼金属置换法;
④电解法.
四种方法在工业上均有应用.古代有:(Ⅰ)火烧孔雀石炼铜;
(Ⅱ)湿法炼铜.现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁.对它们的冶炼方法的分析中不正确的是( )
A.(Ⅰ)① B.(Ⅱ)② C.(Ⅲ)③ D.(Ⅳ)④
本题参考答案:B
2.阅读下面材料,并回答问题.
铝可以从铝土矿中获取.铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源.假如我们对铝的消费保持现有的速度,我们获得生产足够的铝所需的铝土矿仅能维持30年左右.由此看来,保护现有自然资源和对非再生资源的再利用,是值得我们考虑的.但废物回收仍有相当大的难度,其关键的因素主要涉及旧金属的收集、与其它废物的分离,回收和提炼金属的费用、金属本身的价值等.(已知1mol电子电量约为105C)
(1)试说明回收铝的过程中存在的困难
(2)为什么金的回收率比铝的回收率要大得多?答:
(3)常温下,SiO2与强碱或强酸是很难反应的.现利用盐酸、氢氧化钠溶液、氨气、二氧化碳和水从铝土矿中提取纯净的Al2O3.试设计一个适用于工业生产上提纯Al2O3的实验方案.用化学方程式表示.
(4)假定用6V直流电源供电进行电解,制2.7吨Al需要多少KJ的电能?
(5)在1.01×105Pa,27℃时,每生产1molAl,理论上在阳极生成氧气的体积为多少升?
本题参考答案:(1)①旧金属的收集;②与其它废物的分离;③回收和提炼金属的费用;④金属本身的价值;⑤人们的环境意识薄弱.(能答以上任意两点即可,其它合理答案均可)
(2)①金属本身的价值 ②金属的活泼性
(3)①Al2O3+2NaOH![]() 2NaAlO2+H2O
2NaAlO2+H2O
②NaAlO2+CO2+2H2O![]() Al(OH)3
Al(OH)3![]() +NaHCO3
+NaHCO3
③2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
(4)1.8×108KJ (5)18.5L

【同步达纲练习】
1.电解熔融氧化铝时,如果阴极析出9g铝,那么理论上有几摩尔电子发生了转移?( )
A.3mol B.1mol C.0.1mol D.2mol
2.要冶炼金属Mg,可采用的方法是( )
A.电解MgCl2溶液 B.电解熔融MgCl2
C.加热MgO D.用碳还原MgO
3.从海水中提取金属镁的主要流程是( )
A.海水![]() Mg(OH)2Mg
Mg(OH)2Mg
B.海水![]() MgCl2
MgCl2![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2
MgCl2![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
4.下列说法中,正确的是( )
A.自然界的金属都以化合态的形式存在
B.在冶炼铁的反应中CO是还原剂
C.我国的钨、钼、钛、稀土金属等储量均居世界前列
D.在动植物体内都不含金属元素
5.下列各种方法中,适用于炼制相应金属的是( )
A.加热氧化钙 B.电解熔融氯化钠
C.CaO与Al粉共热 D.用碳还原氧化铜
6.下列各组金属中最适用CO或H2把它们从其氧化物中还原出来的是( )
A.Ca、Mg、Al B.Fe、Cu、W
C.Al、Fe、Na D.Hg、Ag、Zn
7.用H2还原某二价金属的氧化物成单质.每1gH2可还原36g氧化物,则此金属可能是下列的( )
A.Zn B.Pb C.Fe D.Cu
8.下列在溶液中进行的反应方程式正确的是( )
A.2AgCl+Cu![]() CuCl2+2Ag B.Cu+2FeCl3
CuCl2+2Ag B.Cu+2FeCl3![]() CuCl2+2FeCl2
CuCl2+2FeCl2
C.K+AgNO3![]() Ag+KNO3 D.2Zn+PbCl4
Ag+KNO3 D.2Zn+PbCl4![]() Pb+2ZnCl2
Pb+2ZnCl2
9.冶炼金属常用以下几种方法:①以C或CO或H2作还原剂还原;②电解法;③热分解法;④铝热反应,这些方法各适宜来冶炼哪些金属?
①法适宜于 ;
②法适宜于 ;
③法适宜于 ;
④法适宜于 .
10.用足量的CO还原14g铁的氧化物的混和物,将生成的气体通入足量的澄清的石灰水中,生成沉淀25克,则这种混和物可能是 ,在这些混合物中,各成分的物质的量之比是 .
①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4
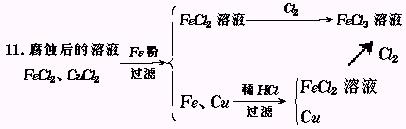
11.电子工业中常用FeCl3溶液腐蚀线路铜板,其反应方程式为:
2FeCl3+Cu![]() 2FeCl2+CuCl2
2FeCl2+CuCl2
请设计实验步骤,从腐蚀后的溶液中回收铜和FeCl3溶液.
12.用纯净的铝土矿(Al2O3)、冰晶石和二氧化锰为原料可制取金属锰,其化学反应方程式为 , .
13.自然界中含量最多的金属元素是 ,能以游离态存在的金属是 .人们日常应用的金属材料最多为 .
14.工业上冶炼金属一般用 、 或 法.冶炼金属铝采用的方法是 ,冶炼金属铁采用的方法是 ,冶炼金属钠采用的方法是 .这些方法的实质是 .
15.写出下列冶炼金属的化学反应方程式:
(1)用红锌矿(ZnO)治炼锌 .
(2)用磁铁矿(Fe3O4)冶炼铁 .
(3)用铝矾土(Al2O3)冶炼铝 .
(4)用食盐(NaCl)冶炼钠 .
【素质优化训练】
1.用铝热法还原下列化合物,制取金属1mol,消耗铝最少的是( )
A.MnO2 B.WO3 C.Co3O4 D.Cr2O3
2.高温下冶炼某些金属时,需要一定性质的耐火材料.已知某金属化合物的熔融状态属于碱性,冶炼该金属时,下列耐火材料可以选用的是( )
A.氧化镁耐火砖 B.石英耐火砖
C.氧化铝耐火砖 D.石墨耐火砖
3.有一工业废水,已知其中含有大量Fe2(SO4)3和FeSO4,少量Ag+和Na+,以及部分泥沙.试设计一个既经济又合理的方案回收金属银和制取绿矾晶体的实验方案,分步列出实验步骤.并简要说明每一步骤的目的.
4.a克CuO和碳粉的混合物,在无氧的条件下加热一段时间并冷却,称得质量为b克,若反应中碳粉只能转化为CO2,求(1)实验中有多少克氧化铜被还原?(2)b的最小值为多少?
5.将1mol木炭粉和nmolFeO在反应器中混合,隔绝空气加强热,(1)可能发生的化学反应有:
①FeO+C![]() Fe+CO↑
②2FeO+C
Fe+CO↑
②2FeO+C![]() 2Fe+CO2↑ ③C+CO2=2CO
④ .
2Fe+CO2↑ ③C+CO2=2CO
④ .
(2)若n<![]() ,充分反应后,反应器中的固体物质是
,气体产物是
.
,充分反应后,反应器中的固体物质是
,气体产物是
.
(3)若n>4,充分反应后,反应器中的固体物质是 ,气体产物是 .
(4)若反应的气体产物是混合物,则n的取值范围是 若混合气体中,CO和CO2的物质的量相等,则n的值是 .
6.科学探测表明,月球表面无大气层,也没有水,更没有任何生命存在的痕迹.月壤中富含氢和氦-3,其中氦-3总量可达100万吨~500万吨.月岩中现已发现有100多种矿石,其中月海玄武岩含钛铁矿FeTiO3可达25%(体积),甚至比我国攀枝花钒钛磁铁矿石更富含钛,且该钛铁可发生下列反应:
FeTiO3+H2![]() Fe+TiO2+H2O.
Fe+TiO2+H2O.
请回答:
(1)你认为人类开发和利用月壤中的3He有何积极意义?
(2)指出该钛铁矿中各金属元素的化合价,并指出月球上的钛铁矿对于人类建立月球基地有何重要意义?
【生活实际运用】
1.从海水中提取多种化工原料,下面是工业上对海水的几项综合利用的示意图:
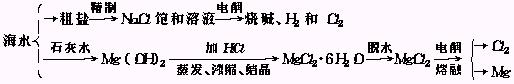
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、![]() 等杂质离子,精制时所用试剂为:盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是 .
等杂质离子,精制时所用试剂为:盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是 .
(2)写出电解饱和食盐水的化学反应方程式: .
(3)用海滩上的贝壳制Ca(OH)2的化学方程式: .
(4)工业上冶炼镁时采用电解MgCl2而不采用电解MgO,其原因是 .
(5)电解无水MgCl2可制得金属镁和氯气,利用副产品Cl2和熟石灰反应可制得漂白粉,反应的化学方程式为 .
2.在一定条件下可实现下列所示物质之间的变化:
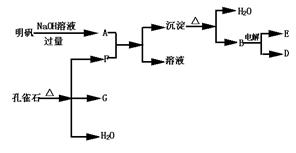
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2.受热易分解,上图中的F是 .
(2)写出明矾与过量的NaOH溶液反应的离子方程式: .
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
(4)每生成1molD的同时,生成 molE.
【知识验证实验】
1.铜变“银币”,“银币”变金币
过程如下:
(1)取银白色金属Zn的粉末,投入NaOH溶液,加热,发生反应(Ⅰ):Zn溶于NaOH得到无色透明的溶液Na2ZnO2,同时放出H2.
(2)把铜币投入热的Na2ZnO2溶液中,片刻,发生反应(Ⅱ):铜币变成“银币”;
(3)把“银币”从溶液中取出,用蒸馏水冲洗干净,并用细软的纸擦干,用坩埚钳夹住,在酒精灯火焰上加热,发生反应(Ⅳ):“银币”变成了与金的色泽几乎完全一样的“金币”.
思考:①“银币”成分是什么?
②“金币”成分是什么?
答案:“银币”是表面覆盖一层锌的铜币
“金币”是铜与锌的合金(黄铜)
2.某课外活动小组拟用下列装置做炼铁原理的实验,同时检测氧化铁的纯度(假设矿石不含其他与CO反应的成分),并除去尾气.CO用H2C2O4![]() CO2↑+CO↑+H2O来制取.与Fe2O3反应的CO需纯净、干燥.
CO2↑+CO↑+H2O来制取.与Fe2O3反应的CO需纯净、干燥.
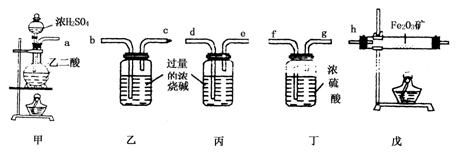
(1)若所制的气体的流向为从左向右时,下列仪器组装连接的顺序是(用a,b……表示)
接 , 接 , 接 ,
接 .
(2)装置乙的作用是 ;装置丙的目的是 .
(3)实验结束后,先熄灭戊处的酒精灯,再熄灭甲处的酒精灯,其主要原因是 .
(4)实验前氧化铁矿粉末的质量为xg,实验后测的乙和丙的质量分别增加了yg和zg,则氧化铁矿粉末中氧化铁的质量分数为 .
【知识探究学习】
世界上古老的文化发源地在使用和冶炼金属的历史上都无一例外的是铜先于铁,你能分析其中的原因吗?
1.铜的冶炼
工业上使用的铜有电解铜(含铜99.9%~99.95%)和精铜(含铜99.0%~99.7%)两种.前者用于电器工业上,用于制造特种合金、金属丝及电线.后者用于制造其他合金、铜管、铜板、轴等.
炼铜的原料是铜矿石.铜矿石可分为三类:(1)硫化矿,如黄铜矿(CuFeS2)、斑铜矿(Cu5FeS4)和辉铜矿(Cu2S)等.(2)氧化矿,如赤铜矿(Cu2O)、孔雀石[CuCO3·Cu(OH)2]、蓝铜矿[2CuCO3·Cu(OH)2]、硅孔雀石(CuSiO3·2H2O)等.(3)自然铜.
铜矿石中铜的含量在1%左右(0.5%~3%)的便有开采价值,因为采用浮选法可以把矿石中一部分脉石等杂质除去,而得到含铜量较高(8%~35%)的精矿砂.
从铜矿石冶炼铜的过程比较复杂.以黄铜为例,首先把精矿砂、熔剂(石灰石、砂等)和燃料(焦炭、木炭或无烟煤)混合,投入“密闭”鼓风炉中,在1000℃左右进行熔炼.于是矿石中一部分硫成为SO2(用于制硫酸),大部分的砷、锑等杂质成为As2O3、Sb2O3等挥发性物质而被除去:
2CuFeS2+O2=Cu2S+2FeS+SO2↑
一部分铁的硫化物转变为氧化物:
2FeS+3O2=2FeO+2SO2↑
Cu2S跟剩余的FeS等便熔融在一起而形成“冰铜”(主要由Cu2S和FeS互相溶解形成的,它的含铜率在20%~50%之间,含硫率在23%~27%之间),FeO跟SiO2形成熔渣:
FeO+SiO2=FeSiO3
熔渣浮在熔融冰铜的上面,容易分离,借以除去一部分杂质.
然后把冰铜移入转炉中,加入熔剂(石英砂)后鼓入空气进行吹炼(1100~1300℃).由于铁比铜对氧有较大的亲和力,而铜比铁对硫有较大的亲和力,因此冰铜中的FeS先转变为FeO,跟熔剂结合成渣,而后Cu2S才转变为Cu2O,Cu2O跟Cu2S反应生成粗铜(含铜量约为98.5%).
2Cu2S+3O2=2Cu2O+2SO2↑
2Cu2O+Cu2S=6Cu+SO2↑
再把粗铜移入反射炉,加入熔剂(石英砂),通入空气,使粗铜中的杂质氧化,跟熔剂形成炉渣而除去.在杂质除到一定程度后,再喷入重油,由重油燃烧产生的一氧化碳等还原性气体使氧化亚铜在高温下还原为铜.得到的精铜约含铜99.7%.
2.废金属的利用
废金属弃置不用,不仅是资源的极大浪费,而且占用土地,污染环境.目前,世界各国都十分重视废金属的回收再用.
回收的废旧钢铁主要用于炼钢,利用某些边角余料可以生产某些设备、仪器的零件等.
据计算,利用1t废钢炼钢,可节约矿石2t、焦炭1t、石灰石0.5t.回收1t铬不锈钢,可节约铬0.13t.回收1t镍铬钢,可节约铬0.18t、镍0.09t.同时,利用回收金属进行冶炼,还可以节约大量能源.
3.我国的矿产资源
矿产资源是自然资源的一部分,是大自然赋予人类的宝贵财富,是我国社会主义现代化建设的重要物质基础,我国生产所需的80%左右的原材料来自矿产资源.
我国幅员辽阔,是世界上矿产资源比较丰富、矿产品种比较齐全的国家.我国矿产资源总值居世界第三位,但人均拥有量约为世界人均水平的1/3,居世界第80位.
我国已发现的矿产有168种,其中已探明储量的有152种,已开发利用的有132种,已发现的矿床、矿化点有二十多万处.
在金属矿产资源上,钨、锑、钛、稀土、菱镁矿居世界第一位,钒居第二位,锌、钼居世界第三位.金属矿产储量相对不足的有银、铁、铅、铜、金、镍等,储量相对短缺的有钾、铂、铬等.

参考答案:
【同步达纲练习】
1.B 2.B 3.C 4.BC 5.BD 6.B 7.C 8.D
9.①Fe、Zn、Cu等一类中等活泼金属的冶炼;
②活泼金属Na、Mg、Al等的冶炼;
③Ag、Hg等一类不活泼金属的冶炼;
④V、Nb、Mn等难熔金属.
10.①或③ 1∶2或1∶1
![]()
13.Al,金、铂以及少量的银和铜,合金或纯金属.
14.热分解法、热还原法、电解法.电解熔融的Al2O3,用CO还原Fe2O3或Fe3O4,电解熔融的NaCl,使金属化合物的金属离子得到电子变成金属原子.
15.(1)ZnO+CO![]() Zn+CO2
Zn+CO2
(2)Fe3O4+4CO![]() 3Fe+4CO2
3Fe+4CO2
(3)2Al2O3 ![]() 4Al+3O2↑
4Al+3O2↑
(4)2NaCl![]() 2Na+Cl2↑
2Na+Cl2↑
【素质优化训练】
1.C 2.A
3.①过滤除去泥沙 ②滤液中加入过量铁粉,使Ag+还原为Ag、Fe3+还原为Fe2+ ③过滤,向滤渣中加稀H2SO4,使Fe充分溶解后过滤分离出Ag④将③中两次滤液合并,蒸发浓缩,冷却使绿矾晶体析出 ⑤过滤,得绿矾晶体,Na+留在B液中.
4.(1) ![]() (a-b) (2)
(a-b) (2) ![]() a克
a克
5.
(1)FeO+CO![]() Fe+CO2 (2)Fe和FeO;CO2
Fe+CO2 (2)Fe和FeO;CO2
(3)C和Fe;CO (4) ![]() <n<1;
<n<1;![]()
6.(1)3He将是人类可长期使用的清洁、安全、高效的核聚变发电燃料
(2) ![]() 、
、![]() ;不仅是铁、钛、氧元素的主要资源,而且FeTiO3与H2反应将是人类建立月球基地获取水资源的重要途经.
;不仅是铁、钛、氧元素的主要资源,而且FeTiO3与H2反应将是人类建立月球基地获取水资源的重要途经.
【生活实际运用】
1.(1)NaOH、BaCl2、Na2CO3、HCl
(2)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)CaCO3![]() CaO+CO2 CaO+H2O
CaO+CO2 CaO+H2O![]() Ca(OH)2
Ca(OH)2
(4)MgO的熔点高,消耗较多能源
(5)2Cl2+2Ca(OH)2![]() CaCl2+Ca(ClO)2+2H2O
CaCl2+Ca(ClO)2+2H2O
2.(1)CO2
(2)Al3++4OH-![]()
![]() +2H2O
+2H2O
(3)3CuO+2Al![]() Al2O3+3Cu (4)3/4
Al2O3+3Cu (4)3/4
【知识验证实验】
(1)adefghib (2)吸收CO2,使尾气CO点燃燃烧;除去混在CO中的CO2 (3)防止还原产生的Fe受热时被氧化 (4) ![]() ×100%
×100%
