高二年级
化学练习题(一)
一. 选择题(每小题有1—2个选项符合题意)
1. 在一定条件下,0.1mol/L的某一元弱酸中未电离的分子数与弱酸电离生成的离子数之比是25︰1,则该酸在此条件下的电离度为:
A. 4% B. 2% C. 1.96% D. 2.04%
2. 镁粉是焰火、闪光粉、鞭炮中不可缺少的原料,工业上制造镁粉是将镁蒸气在某种冷却剂中冷却。下列可作冷却剂的是:
①空气 ②二氧化碳 ③氩气 ④氢气 ⑤氮气 ⑥水
A. ①② B. ③④ C. ③⑥ D. ③⑤
3. 某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2,取1.55g该固体恰好与10mL 4mol·L-1硝酸反应完全,生成Mg(NO3)2溶液,则x值为:
A. 1 B. 2 C. 3 D. 5
4. 两份铝,一份加入强碱液,一份加入盐酸中,要使前后反应收集到的氢气量之比为1︰2,则两份铝质量比为:
A. 1︰2 B. 2︰1 C. 1︰4 D. 1︰1
5. 下列各组金属混和物的质量相同,它们分别跟足量盐酸反应,在相同的条件下产生的氢气体积也相同,则其中锌的含量最多的是:
A. 锌和铁 B. 锌和铝 C. 锌和镁 D. 锌和钠
6. Al和NaOH水溶液反应中,氧化剂与还原剂的物质量之比为:
A. 1︰1 B. 2︰1 C. 3︰1 D. 4︰1
7. 一定量的钠、镁、铝分别与足量盐酸反应,放出的氢气的质量之比为1︰2︰4,则钠、镁、铝三种金属的物质的量之比为:
A. 1︰1︰1 B. 4︰2︰1 C. 2︰3︰4 D. 3︰3︰4
8. 把镁、锌、铝三种金属的混和物与足量的稀硫酸充分反应,得标准况状下的氢气2.8升,则金属混和物中,三种金属的物质的量之和可能是:
A. 0.10mol B. 0.125mol C. 0.15mol D. 0.20mol
9. 锌粉、铝粉、铁粉的混和物44g与一定量的浓度为17.25%的H2SO4溶液恰好反应,将溶液蒸发结晶得干燥的无水固体盐140g,则放出的气体体积为(标况):
A. 22.4L B. 33.6L C. 6.72L D. 无法求算
10. 下列反应中没有Fe3+→Fe2+的变化的是:
A. 将铁屑投入到略带黄色的粗盐酸中 B. 过量的铁屑与稀硝酸反应
C. 向氯化铁溶液中投入铜片 D. 过量的稀硝酸与铁屑反应
11. 下列制取绿矾的方法最适宜的是:
A. 铁屑与稀硫酸 B. FeO与稀硫酸 C. Fe(OH)2与稀硫酸 D. Fe2(SO4)3与铜粉
12. a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、c均能与稀硫酸反应放出气体;②b与d 的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硝酸中发生钝化。由此判断.a、b、c、d、e分别是:
A. Fe、Cu、Al、Ag、Mg B. Al、Cu、Mg、Ag、Fe
C. Mg、Cu、Al、Ag、Fe D. Mg、Ag、Al、Cu、Fe
13. 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的:
A. CaCO3(s) B. Na2SO4溶液 C. KNO3溶液 D. CuSO4(s)
14. 100℃时关于纯水的叙述正确的是:
A. pH=6,呈弱酸性 B. [H+]=10-6mol/L,溶液为中性
C. Kw值是常温时的10-2倍 D. pH=7,溶液为中性
15. 现有氧化铜和氧化铁的混和物共10克,用氢气充分还原,消耗标况下氢气3.36升。则氧化铜的质量为:
A. 4克 B. 5克 C. 6克 D. 6.5克
16. 将一小块金属钠置于硫酸铜水溶液中,不可能发生的反应是:
①CuSO4+2Na=Na2SO4+Cu ②CuSO4+2NaOH=Cu(OH)2↓+2Na2SO
③2Na+2H2O=2NaOH+H2↑ ④Cu(OH)2=CuO+H2O
A. ① B. ①④ C. ④ D. ②③
17. 将40mL 1.5mol·L-1的CuSO4溶液与30mL 3mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中[Cu2+]或[OH-]都已变得很小,可忽略,则生成沉淀的组成可表示为:
A. Cu(OH)2 B. CuSO4·Cu(OH)2
C. CuSO4·2Cu(OH)2 D. CuSO4·3Cu(OH)2
18. 下列操作中,能使电离平衡H2O![]() H++OH-,向右移动且溶液呈酸性的是:
H++OH-,向右移动且溶液呈酸性的是:
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使pH=6
19. 要使水的电离平衡向右移动,且使pH值<7,可采取的措施是:
A. 加少量NaOH B. 加少量NH4Cl C. 加少量盐酸 D. 加热
20. 常温下,一定浓度的NaOH溶液与某一浓度的乙酸钠溶液中水的电离度之比为10-7,则这两种溶液的pH值之和为:
A. 22 B. 21 C. 15 D. 14
21. MgCl2和NaHCO3按物质的量之比为1︰2混合制成溶液,加热蒸干得到的固体是:
A. Mg(HCO3)2、NaCl B. Mg(OH)2、NaCl C. MgCl2、Na2CO3 D. MgCO3、NaCl
22. 加入氯化钙溶液不产生沉淀,而加入氢氧化钡溶液时有沉淀产生的是:
A. 亚硫酸氢钠溶液 B. 碳酸氢钠溶液 C. 碳酸钠溶液 D. 氯化钠溶液
23. 将amol/L的碳酸氢钙溶液跟bmol/L的烧碱溶液等体积混合后的溶液中含有四种生成物,则下列a与b的关系正确的是:
A. a︰b≥1︰2 B. 1︰2<a︰b<1︰1 C. 2a=b D. a=2b
二. 填空题:
24. 选用适当的编号填入空格:(A)软水 (B)暂时硬水 (C)永久硬水
(1)蒸馏水是
(2)已经煮沸处理的海水是
(3)把过量的二氧化碳通入石灰乳后,得到的澄清溶液是
(4)将天然水流过装有磺化煤的离子交换柱,所得的水是
25. 已知:
①短周期元素A、B、C、D的原子序数依次增大。
②A、B、D的单质都能在C的单质中燃烧,分别生成化合物X、Y、Z。
③X分别与Y、Z反应生成化合物E、F。
④单质D也能在化合物Y中燃烧生成B的单质和化合物Z。
⑤单质D还能与热的化合物X反应生成A的单质和化合物F。
请回答下列问题:
(1)写出A的元素符号 。
(2)写出D的原子结构示意图 。
(3)写出④中反应的化学方程式 。
(4)写出⑤中反应的化学方程式 。
26. 据下列信息完成所需回答的问题:
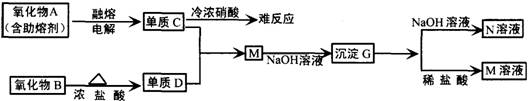
(1)A是 ,D是 ,G是 (填化学式)
(2)元素C位于周期表中第 周期 族。
(3)写出下列反应的离子方程式:
B+浓盐酸
G+NaOH溶液
(4)单质C不与冷浓硝酸反应的原因是
(5)已知一定质量的B与足量的浓盐酸反应生成的D在标准状况下的体积为5.6L,求被氧化的HCl的物质的量(写出计算过程).
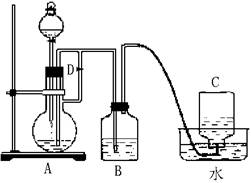 27. 图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:
27. 图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 。A中反应的离子方程式是 。
(2)实验开始时先应将活塞E (填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程_____________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
__________________________________________________________.
三. 计算题:
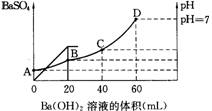 28. 往20mL硫酸和盐酸的混合液中,加入0.05mol/L Ba(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图,计算:
28. 往20mL硫酸和盐酸的混合液中,加入0.05mol/L Ba(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图,计算:
(1)最初混合溶液中H2SO4的物质的量浓度;
(2)最初混合溶液中HCl的物质的量浓度;
(3)B点时溶液的pH是多少?
C点时比A点时pH增加多少?
29. 有一块金属钠投入到盛有100mL氯化镁和氯化铝的混和溶液的烧杯中,发现烧杯中的沉淀先多后少,反应完毕后收集到标准状况下的氢气13.44L,同时得到21.4g沉淀.将此沉淀溶于过量苛性钠溶液中,发现沉淀减轻了15.6g.求原混和溶液中Mg2+、Al3+及Cl-的物质的量浓度.
30. 将一定量的铝和过氧化钠混和物投入一盛有20mL蒸馏水的烧杯中,反应终止时得一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少3.5g,再向所得溶液中滴加3.5mol/L盐酸直至产生的沉淀刚好溶解,消耗盐酸200mL。求原混和物中Al和Na2O2各多少g?
答案:
1 C
2 B
3 C
4 A
5 B
6 C
7 D
8 A
9 A
10D
[1]1 A
[1]2 C
[1]3 B
[1]4 B
[1]5 C
[1]6 A
[1]7 D
[1]8 B
[1]9 B、D
20 B
21 B
22 A、B
23 B
24(1)A (2)C (3)B (4)A
25 (1)H (2)略 (3)2Mg+CO2=2MgO+C (4)Mg+2H2O=Mg(OH)2+H2↑
26(1)Al2O3 Cl2
Al(OH)3 (2)三
ⅢA (3)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O Al(OH)3+OH-=AlO2-+2H2O (4)铝遇到冷浓硝酸钝化 (5)0.5mol
Mn2++Cl2↑+2H2O Al(OH)3+OH-=AlO2-+2H2O (4)铝遇到冷浓硝酸钝化 (5)0.5mol
27 (1)铁屑,Fe+2H+=Fe2++H2↑
(2)打开,H2
(3)关闭活塞E,使FeSO4溶液压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
28 (1)0.05mol/L (2)0.2mol/L (3)1 2lg3
29 1摩/升,3摩/升,11摩/升
30 Al 0.1摩、Na2O2 0.2摩