高二年级化学秋学期期中考试
化 学 试 卷
命题人:刘海平
可能用到的原子量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12
Ca: 40 Cu:64 S: 32 Fe: 56 Mg: 24 P: 31
一、 选择题(每题只有一个正确答案,4分×8=32分):
1、下列说法中正确的是 ( )
A、铵盐是由非金属元素互相结合成的化合物,因而是共价化合物
B、铵盐与碱液共热都能得到氨气
C、除去食盐中少量的NH4Cl:加过量的烧碱溶液后加热蒸干
D、铵盐受热分解都能生成使红色石蕊试纸变蓝的气体
2、相同温度下,相同物质的量浓度的下列物质的水溶液,导电性最好的是 ( )
A、![]() B、
B、![]() C、NaOH D、
C、NaOH D、![]()
3、下列能正确反映醋酸跟氢氧化钠溶液反应的离子方程式是 ( )
A、![]()
B、![]()
C、![]()
D、![]()
4、某单质能跟浓HNO3 反应,若参与反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的化合价可能是 ( )
(1)+1 (2)+2 (3)+3 (4)+4
A、(1)(2)(3)(4) B、(1)(2) C、(3)(4) D、(2)(4)
5、将下列固体于隔绝空气的密闭容器中加热,在加热过程中发生了化学反应,且冷却后又聚集为原来物质的是 ( )
A、NH4Cl B、KMnO4 C、碘片 D、红磷
6、反应4NH3+5O2 ![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
( )
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
( )
A.V(O2)=0.01mol·L-1 ·s-1 B.V(NO)=0.008mol ·L-1 ·s-1
C.V(H2O)=0.015mol· L-1 ·s-1 D.V(NH3)=0.002mol· L-1 ·s-1
7、一定温度下,在固定容积的密闭容器中,可逆反应:
mA(气)+nB(气) ![]() pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率VA:VB:VC:VD=m:n:p:q,其中,能说明反应已达到平衡的是 ( )
pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率VA:VB:VC:VD=m:n:p:q,其中,能说明反应已达到平衡的是 ( )
A.只有③④ B.②③④ C.①⑵⑶④ D.①②③④⑤
8、在某一密闭容器中,充入一定量的HI气体,发生反应2HI(气) ![]() H2(气)+I2(气) (正反应为吸热反应),在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
( )
H2(气)+I2(气) (正反应为吸热反应),在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
( )
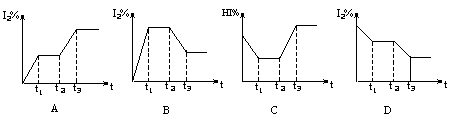 |
二、 选择题(每题有一到两个正确答案,4分×10=40分):
9、下列事实,不能用勒夏特列原理解释的是 ( )
A.溴水中有下列平衡
Br2+H2O ![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)
![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2
![]() CO2+NO(正反应为放热反应)
CO2+NO(正反应为放热反应)
升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
10、翰林汇下列可逆反应达平衡状态后,降温可以使混和气体平均分子量减小的是( )
A.H2(气)+Br2(气) ![]() 2HBr(气) (正反应为放热反应)
2HBr(气) (正反应为放热反应)
B.N2(气)+3H2(气) ![]() 2NH3(气) (正反应为放热反应)
2NH3(气) (正反应为放热反应)
C.2SO3(气) ![]() 2SO2(气)+O2(气) (正反应为吸热反应)
2SO2(气)+O2(气) (正反应为吸热反应)
D.4NH3(气)+5O2(气) ![]() 4NO(气)+6H2O(气)
(正反应为放热反应)
4NO(气)+6H2O(气)
(正反应为放热反应)
11、在一定条件下,将6体积的NO2和一定体积的NO与4.5体积的氧气组成的混和气体置于试管中,并将试管倒置于水中,充分反应后,剩余1.5体积气体,则原NO体积可能为 ( )
A、3体积 B、2体积 C、5.5体积 D、5体积
12、把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是
(
)
A、氧气 B、二氧化氮
C、二氧化氮和氧气
D、二氧化氮和一氧化氮
13、把0.05molNaOH固体分别加入下列100mL液体中,溶液的导电性基本不变的是: ( )
A 、自来水 B 0.5mol·L-1的盐酸
C 、0.5mol·L-1的醋酸 D 0.5mol·L-1的氨水
14、 1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标准状况下测定)。将盛有此气体的容器倒扣在水中,通入一定体积的O2(标准状况下),恰好使气体完全溶于水中,则通入O2的体积是 ( )
A、504mL B、168mL C、336mL D、224mL
15、将2 mol SO2和2 mol SO3气体,充入固定体积的密闭容器,在一定条件下发生下列反应:2SO2+O2 ![]() 2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
( )
2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
( )
A.2 mol SO2+1mol O2 B.4 mol SO2+1mol O2
C.2 mol SO2+1mol O2 +2 mol SO3 D.3 mol SO2+1 mol SO3
16、氮和钠形成的化合物Na3N,能与水剧烈反应产生NH3,下列叙述正确的是( )
A、Na3N与水的反应是非氧化还原反应
B、Na3N 是共价化合物
C、Na3N若与足量盐酸作用可生成两种盐
D、Na3N中钠离子半径大于氮离子半径
17、下列各组离子在水溶液中可以大量共存的是 ( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
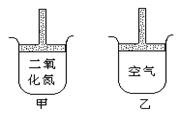 18、常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮和空气,现分别进行下列两个实验:①将两容器置于沸水中加热 ②在活塞上都加2千克的砝码,在以上两情况下,甲和乙容器的体积大小的比较,正确的是
( )
18、常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮和空气,现分别进行下列两个实验:①将两容器置于沸水中加热 ②在活塞上都加2千克的砝码,在以上两情况下,甲和乙容器的体积大小的比较,正确的是
( )
A.①甲>乙 ②甲>乙 B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙 D.①甲>乙 ②甲=乙
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、 填充题(57分):
19(12分)、在一个1升的密闭容器中,加入2molA和1molB,发生下列反应:
2A(g)+B(g) ![]() 3C(g)+D(s)
3C(g)+D(s)
达到平衡时,C的浓度为1.2mol/L。
(1)维持容器的温度不变,若缩小容器的体积,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)
(2)维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是: 。
A、4molA+2molB B、3molC+1molD
C、2molA+1molB+1molD D、1molA+0.5molB+1.5molC+0.2molD
(3)若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件是 。
20(4分)、将两种浓度都是1mol/L 的气体X2、Y2在密闭容器中反应生成Z,平衡时测得各物质的浓度是:c(X2)=0.58mol/L,c(Y2)=0.16mol/L, c(Z)=0.84mol/L,则Z的分子式为 。
21(8分)、 有A、B、C、D、E、F、G、H八种气体,根据下列事实判断分别是何种气体。
(1)A、B、D、F是单质;
(2)把A和B混合,在光照下发生爆炸,生成气体C;
(3)A和D在一定条件下发生反应生成气体E;
(4)D和F在放电条件下可生成气体G;
(5)G与空气混合时,由无色变成红棕色气体H;
(6)E与C反应冒白烟;
(7)H溶于水生成一种强酸和气体G;
写出各种气体的化学式:
A_________,B_________,C_________,D_________,
E_________,F________,G_________,H_________。
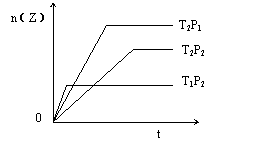 22(3分)、
22(3分)、
反应2X(g)+Y(g)![]() 2Z(g)
2Z(g)
在不同的温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图所示。
则正反应为 热反应;
T1 、T2 P1、P2的关系是 T1 T2
P1 P2
23(12分)、在0、1mol/L醋酸溶液中存在下列平衡:
CH3COOH ![]() CH3COO-+H+当改变条件时表中各项内容有何变化?
CH3COO-+H+当改变条件时表中各项内容有何变化?
| 改 变 条 件 | C(CH3COO-) | C(H+) | 电离平衡移动方向 |
| 加入CH3COONa | |||
| 加入少量NaOH固体 | |||
| 加水 | |||
| 加少量Zn粒 |
24(15分)、在10℃和4.000×105Pa的条件下,反应aA(g)![]() dD(g)+eE(g)建立平衡后,保持温度不变,改变压强。下表列出了不同压强下反应建立平衡后物质D的浓度(在改变压强过程中无其它副反应发生):
dD(g)+eE(g)建立平衡后,保持温度不变,改变压强。下表列出了不同压强下反应建立平衡后物质D的浓度(在改变压强过程中无其它副反应发生):
| 压强(Pa) | 4.00×105 | 6.00×105 | 1.00×106 | 2.00×106 |
| c(D)(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
(1)从表中数据分析,压强从4.00×105到6.00×105时,平衡向 移动(填“正”或“逆”),理由是: 。
(2)压强从1.00×106 Pa到2.00×106 Pa时,平衡向 移动,试推断此时平衡向该方向移动的两个必要条件:
。
四、 计算题(强化班不做,普通班做,计21分):
25(7分)、同温同压下,24体积的NO2和N2的混合气体,通过水后气体只剩12体积。问原混合气体中NO2和N2体积比是多少?
26(14分)、 在一定条件下,合成氨反应在2L密闭容器中进行,经5s后达到平衡,测得体系中NH3为4 mol,起始与平衡时的压强之比为13∶8,且C(H2)始∶C(H2)平 ==4∶1,求:H2的反应速率及N2的转化率。
五、计算题(强化班做,普通班不做,计21分):
27(5分)、某化肥厂用![]() 制备
制备![]() 。已知:由
。已知:由![]() 制
制![]() 的产率是96%,
的产率是96%,![]() 制
制![]() 产率是92%,
产率是92%,![]() 跟
跟![]() 反应生成
反应生成![]() ,则制
,则制![]() 所用去的氨气占总消耗氨气的质量分数为多少?(不考虑生产中其它损耗)
所用去的氨气占总消耗氨气的质量分数为多少?(不考虑生产中其它损耗)
28(8分)、硝酸工业尾气中氮的氧化物(NO、NO2)是主要的大气污染物之一。可用以下方法治理,其主要原理如下:
2NO2 + 2NaOH === NaNO3 + NaNO2 + H2O
NO2 + NO + 2NaOH == 2NaNO2 + H2O
现有标准状况下aL NO2 和bL NO的混合气体,恰好可被200mlNaOH溶液完全吸收。
(1)欲保证工业尾气全部被吸收,则a:b 的值应控制在 范围;
(2)NaOH溶液的物质的量浓度是 mol/L ;
(3)试讨论a 、b 的值与生成的NaNO3 和NaNO2物质的量(设分别为n1和n2)之间的关系:
①当生成的产物全部为NaNO2时:n1=0 , n2= ;
②当产物中兼有NaNO3 和NaNO2时:n1= , n2= (用含a、b的代数式表示);
(4)若在标准状况下有氮氧化物的混合物 2.016L恰好与50ml ,2.0mol/L的NaOH溶液反应完全,且生成NaNO2和NaNO3物质的量的比值为4:1,则在混合气体中NO2和NO气体的体积比为 。
29(8分)、9.8g铁镁混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到0.2molNO气体。在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为多少?
高二化学期中试卷
参考答案
一、二选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | A | D | A | D | A | A | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | BC | C | B | C | C | AC | CD | B |
三、填充题:
19、(1)平衡 不 移动
(2)C的浓度仍是1.2mol/L的是: BCD 。
(3) D的起始物质的量应满足的条件是 大于0.6mol 。
20、Z的分子式为 XY2或Y2X 。
21、写出各种气体的化学式:
A_____H2____,B____Cl2_____,C___HCl______,D____N2_____,E_____NH3____,F___O2_____,G____NO_____,H_____NO2____。
22、放 > >
23、
| 改 变 条 件 | C(CH3COO-) | C(H+) | 平衡移动方向 |
| 加入CH3COONa | 增大 | 减小 | 左 |
| 加入少量NaOH固体 | 增大 | 减小 | 右 |
| 加水 | 减小 | 减小 | 右 |
| 加少量Zn粒 | 增大 | 减小 | 右 |
24、
(1)平衡向 逆 移动(填“正”或“逆”),理由是: 从 4.00×105Pa到 6.00×105 Pa,D的浓度增大不到1.5 倍 。
(2)平衡向 正反应方向 移动,
两个必要条件: A、D必为气态,E为非气态,且a>d 。
四、计算:
25、3∶1
26、C(H2)=6/2=3mol/L V(H2)=3/5=0.6 mol· L-1 ·s-1
N2转化率=(2/2.4)×100%=83.3%
27、答:制![]() 所用去的氨气占总消耗氨气的质量分数为53.1%
所用去的氨气占总消耗氨气的质量分数为53.1%
28、(1)a/b≥1
(2) (a+b)/44.8
(3) ①n1=0 n2=(a+b)/22.4 ②n1= (a-b)/44.8 n2=(a+3b)/44.8
(4) (5:3)
29、20g
翰林汇