高二年级化学学科质量检测试卷
一、选择题:(每题只有一个正确答案)
1.目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉
及的是
A、二氧化硫 B、二氧化碳 C、二氧化氮 D、可吸入颗粒物
2.美国科学家发现C60是一种新的分子,它具有空心的类似足球的结构,被称为“分子足球”。最近日本科学家认为世界上还存在另一种“分子足球”N60,它与C60的结构相似,并且在高温机械接触后,其中积蓄的巨大能量会在一瞬间放出来。对于N60下列说法正确的是
A. N60是由共价键构成的空心圆球形结构,所以是一种共价化合物
B. N60和14N都是氮的同位素
C. N60没有同素异形体
D. N60的发现开辟了能源世界新天地,将来有可能会成为发展前途的高能燃料
3.我国的纳米基础研究能力已挤身世界前列,2001年我国十大科技成就之一就是合成了一种纳米材料:RN。已知该化合物中与氮微粒结合的Rn+核外有28个电子。则R位于元素周期表的
A、第三周期ⅤA族 B、第四周期ⅢA族
C、第五周期ⅢA族 D、第四周期ⅤA族
4.四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种流体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是
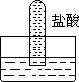
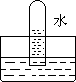

A B C D
5.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A 、1︰1︰1 B、2︰2︰1 C、2︰3︰1 D、4︰3︰2
6.在甲、乙、丙、丁四个烧杯中分别加入4.6g钠、6.2g氧化钠、7.8g过氧化钠和8.0g氢氧化钠,然后各加入100mL水,搅拌,使固体完全溶解。则甲、乙、丙、丁溶液中溶质的质量分数大小顺序是
A.甲>乙=丙>丁 B.甲<乙<丙<丁 C.甲=丁<乙=丙 D.丁<甲<乙<丙
7.膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。以下关于PH3的叙述正确的是
A、PH3是非极性分子 B、PH3分子中有未成键的电子对
C、PH3是一个强氧化剂 D、PH3分子中的P—H键是非极性键
二、选择题:(每题有1~2个正确答案)
8.下列操作中固体可完全溶解的是
A、1mol Al与含1mol H2SO4的稀H2SO4溶液共热
B、1mol Cu与含2mol H2SO4的浓H2SO4溶液共热
C、1mol Cu与含4mol HNO3的浓HNO3溶液共热
D、1mol MnO2与含4mol HCl的浓HCl溶液共热
9.NO和CO都是汽车尾气里的有害物质,它们能缓缓地起反应生成氮气和二氧化碳气:2NO+2CO=N2+2CO2。对此反应下列叙述正确的是
A、使用催化剂能加快反应速率
B、改变压强对反应速率无影响
C、冬天气温低,反应速率小,对人危害更大
D、无论外界条件怎么改变,均对化学反应速率无影响
10.下列离子方程式书写正确的是
A.次氯酸钙溶液中通人过量二氧化碳:
Ca2++2ClO-+H2O+CO2→CaCO3↓+2HClO
B.氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-→3Fe3++2H2O+NO↑
C.澄清石灰水与少量小苏打溶液混合:
Ca2+十OH-+HCO3-→CaCO3↓+H2O
D.AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O
11.NA为阿佛加德罗常数,下述正确的是
A、80g硝酸铵含有氮原子数为2NA
B、1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C、标准状况下,11.2LSO3所含分子数为0.5 NA
D、在标准状况下,Cl2与H2的混合气22.4L,光照后原子数为2NA个
12.氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生,下列叙述不正确的是
A、NH4H的电子式是: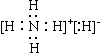
B、NH4H固体投入少量水中,有两种气体产生
C、NH4H中的H-离子半径比锂离子半径大
 D、NH4H溶于水后,形成的溶液呈酸性
D、NH4H溶于水后,形成的溶液呈酸性
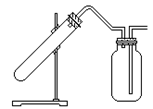
13.右图是制取和收集某气体的实验装置,可用于
A.用Zn与稀HCl反应制H2
B.用Na2O2与H2O反应制O2
C.用Cu与稀HNO3反应制NO
D.用MnO2与浓HCl反应制Cl2
14.硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成
A.S2- B.S C.SO32- D.SO42-
15.1.6g
Cu与8 mol·L-1、50mL
HNO3恰好完全反应,硝酸的还原产物有NO和NO2,反应后测得溶液中H+浓度为a
mol·L-1(生成水的体积忽略不计),则此时溶液中所含NO3-的物质的量为
A、(a+1)mol
B、0.4+0.05amol C、(a+0.05)mol
D、0.05(a+1)mol
三、填空题:
16.写出四种共价分子(其分子都只有10个质子和10个电子)的电子式:① ,② ,③ ,④ ,其中属极性分子的是 ,属非极性分子的是 ,分子的空间构形呈三角锥形的是 ,属正四面体的是 ,它们的水溶液呈弱酸性的是 ,呈弱碱性的是 。
17.有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、
SO42-、CO32-、NO3- 、Cl-、I-,取该溶液进行如下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
⑶取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 ,还不能确定是否存在的上述离子有 。
18.用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
已知:①NO+NO2+2OH-→2NO![]() +H2O ②气体液化温度:NO2 21℃ NO -152℃
+H2O ②气体液化温度:NO2 21℃ NO -152℃
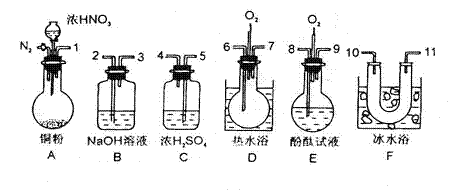 试回答:(1)仪器的连接顺序(按左→右连接,填各接口的编号)为
试回答:(1)仪器的连接顺序(按左→右连接,填各接口的编号)为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)装置F的作用是
(5)如果O2过量,则装置B中发生反应的化学方程式为:
19.由于用氯气对饮用水消毒,会使水中的有机物发生氯代,生成有机含氯化合物,与人体有害,世界环保联盟将全面禁止这种消毒方法,建议采用广谱性具有强氧化性的高效消毒剂ClO2。ClO2极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)在ClO2分子中,所有原子是否都满足最外层8电子结构? (填“是”或“否”),其中氯的化合价是 。
(2)欧洲一些国家用NaClO3氧化浓HCl制ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,表示这一反应的化学方程式为 。
(3)我国广泛采用将经干燥空气中稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是 。
我国这一方法较欧洲方法的主要优点是 。
(4)在酸性溶液中,用草酸钠(Na2C2O4)还原NaClO3也可得ClO2,这一反应的离子方程式是 ,此法的优点是 。
20.下图![]() 分别代表有关反应中的一种物质,其中④⑨是单质。请填下以下空白。
分别代表有关反应中的一种物质,其中④⑨是单质。请填下以下空白。
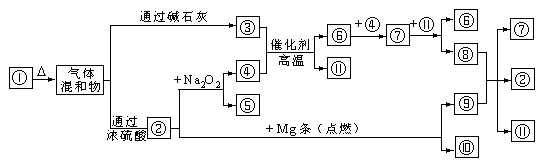
(1)①、②、⑦的化学式分别是
、
、 。
(2)③与④反应的化学方程式是
。
(3)⑧与⑨反应的化学方程式是 。
21.工业制硫酸,最后的产品是98%硫酸或20%发烟硫酸(可看作H2SO4和SO3的混合物,其中SO3的质量分数为20%)。
⑴若98%硫酸可表示为SO3·aH2O,20%发烟硫酸可表示为H2O·bSO3,则a、b的值(可用分数表示)分别是:a = 、b = 。
⑵用m(H2O)=k·n(SO3)分别表示SO3转化成上述两种硫酸时,所用水的质量与SO3的物质的量的关系式(即求k)分别是:m1(H2O) = n1(SO3)、m2(H2O) = n2(SO3)。
四、计算题:
22.取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol/L过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol/L Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00mL/L盐酸恰好完全中和。计算混合物中各物质的质量。
23.硫铁矿高温下被空气氧化产生二氧化硫:4FeS2+11O2=2Fe2O3+8SO2。设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00mol FeS2完全氧化,需要空气的体积(标准状况)为 L
(2)55L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
高二年级化学学科质量检测答案卷
一、二选择题:
| 题号 | 1 | 23 | 3 | 4 | 5 | 6 | 7 |
| 答案 | |||||||
| 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
三、填空题:
16.电子式:① ,② ,③ ,④ 。
极性分子是 ,非极性分子是 ;空间构形呈三角锥形的是 ,属正四面体的是 ;水溶液呈弱酸性的是 ,呈弱碱性的是 。(填分子式)
17. 肯定存在的上述离子有 ,
肯定不存在的上述离子有 ,
还不能确定是否存在的上述离子有 。
18.(1)仪器的连接顺序为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)装置F的作用是
(5)化学方程式为:
19.(1)是否都满足最外层8电子结构? 氯的化合价是 。
(2)化学方程式为 。
(3)化学方程式是 。
我国这一方法较欧洲方法的主要优点是 。
(4)离子方程式是 ,此法的优点是 。
20.(1)①、②、⑦的化学式分别是
、
、 。
(2)③与④反应的化学方程式是 。
(3)⑧与⑨反应的化学方程式是 。
21.⑴a = 、b = 。
⑵m1(H2O) = n1(SO3)、m2(H2O) = n2(SO3)。
四、计算题:
22.
23.(1) L
(2) L
(3)
参考答案:
选择题每题5分
| 题号 | 1 | 23 | 3 | 4 | 5 | 6 | 7 |
| 答案 | B | D | B | C | B | A | B |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| C | AC | BC | AD | D | A | D | D |
16.(10分)
17.(6分)I-、NH4 +、Ba2+ SO42-、CO32-、NO3- 、Mg2+、Al3+、Fe3+
K+、Na +、Cl-
18.(11分)(1)1 5 4 10 11 6 7 2 (10和11可颠倒)[说明:错一个即不给分]
(2)驱赶装置中空气,防止反应产生的NO被氧化
(3)通入O2后装置(D)中有红棕色气体生成
(4)分离NO和NO2(或使NO2液化)[说明:其它合理回答都给分]
(5)4NO2+O2+4NaOH→4NaNO3+2H2O
19.(11分)(1)否 +4 (2)2NaClO3+4HCl Cl2↑+2NaCl+2H2O↑
(3)2NaClO2+Cl2 2ClO2+2NaCl 生成的ClO2中不含Cl2
(4)2ClO3-+C2O42-+4H+
2ClO2↑+2CO2↑+2H2O 析出的ClO2可被CO2稀释
20.(7分)(1)NH4HCO3, CO2, NO2
(2)4NH3+5O2=4NO+6H2O
(3)C+4HNO3 = 2H2O+4NO2+CO2
21.(10分)⑴10/9 209/160 ⑵20 g·mol-1 13.8 g·mol-1
22.(9分)混合物中Na2SO4的质量=1.42g
Na2CO3质量=7.42g
NaHCO3质量=1.68g
23.(11分)(1)308 (2)52 (3) 0.0923