高二年级上学期期中考试化学试题2
测试时间:90分钟 满分:100分
一、 选择题(每小题只有一个选项符合题目要求,每小题2分,共20分)
1. 汽车尾气中污染空气的成分有( )
①CO2 ②CO ③NO ④铅的化合物
A.①②③ B.①③④ C.②③④ D.①②③④
2. 在一定条件下,发生反应:2NO2![]() N2O4,该反应达到化学平衡后,降低温度,混合物的颜色变浅,下列有关说法正确的是( )
N2O4,该反应达到化学平衡后,降低温度,混合物的颜色变浅,下列有关说法正确的是( )
A.正反应为放热反应 B.正反应为吸热反应
C.降温后NO2的浓度增大 D.降温后各物质的浓度不变
3.下列物质属于纯净物的是( )
A.王水 B.硝铵 C.漂白粉 D.氨水
4. 气体甲能使湿润的红色石蕊试纸变蓝,气体乙可在空气中产生白雾,当甲与乙相遇时可能生成( )
A.NH4C1 B.NH4HCO3 C.(NH4)2CO3 D.(NH4)2SO4
5. 下列用途中,应用了氮气不活泼性的是( )
A. 用于合成氨气 B. 用液氮做制冷剂
C. 焊接金属时的保护气 D. 工业上以N2为原料之一制硝酸
6. 对某一可逆反应来说,使用催化剂的作用是( )
A.提高反应物的平衡转化率 B.以同样程度改变正逆反应速率
C.增大正反应速率,降低逆反应速率 D.改变平衡混合物的组分
7. 已知反应:4NH3(g)+5O2(g)=4NO(g)+6H2O(g),若反应速率分别用V(NH3),V(O2),V(NO),V(H2O)(单位是mol·L-1·s-1)表示,则正确的关系是( )
A.4/5V(NH3)=V(O2) B.5/6V(O2)=V(H2O) C.2/3V(NH3)=V(H2O) D.4/5V(O2)=V(NO)
8.下列说法正确的是( )
A.可逆反应的特征是正反应速率总是和逆反应速率相等
B.在其它条件不变时,增大某一反应物的浓度,其他反应物的转化率将增大,而该反应物的转化率却降低
C.在其它条件不变时,升高温度可以使化学平衡向吸热反应的方向移动
D.在其它条件不变时,增大压强一定会破坏气体反应的平衡状态
9.已知N60结构与C60相似,只存在氮氮双键和单键。下列关于N60的说法正确的是( )
A. N60与![]() N都是氮的同位素
B. N60与N2互为同素异形体
N都是氮的同位素
B. N60与N2互为同素异形体
C. N60是共价化合物 D. N60稳定性比N2更强
10.亚硝酸(HNO2)在化学反应中既可作氧化剂又可作还原剂,在亚硝酸作氧化剂时,可能生成的还原产物是( )
A. N2O5 B.NO2 C.N2O3 D. N2O
二、 选择题(每小题有一至二个选项符合题目要求,每小题3分,共30分)
11. 下列离子在水溶液中因发生氧化还原反应而不能大量共存的是( )
A、NH4+、Ba2+、SO42-、Cl- B、I-、H+、Na+、NO3-
C、Mg2+、K+、NO3-、Cl- D、Cu2+、Na+、Br -、CO32-
12. 在一定温度和压强下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%,若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比是( )
A.1/5 B.1/4 C.1/3 D.1/2
13.能正确表示下列反应的离子方程式的是( )
A. 铜片与稀硝酸反应:Cu+2NO3-+4H+=Cu2++2NO↑+2H2O
B. 碳酸氢钠溶液与氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O
C. 实验室用氯化铵和氢氧化钙混合加热制氨气:NH4++OH-=NH3↑+H2O
D. 硫酸溶液和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
14. 可逆反应3A(g)=3B(x)+C(y)(正反应为吸热反应),在一定条件下,达到平衡后,随着温度升高,气体平均相对分子质量变小,则下列叙述正确的是( )
A.x和y可能都是g(气态) B. x和y一定都是g(气态)
C. x和y可能都是s(固态) D.若y是s(固态),则x不一定是g(气态)
15.把分别盛满NH3、HCl、NO2三个等体积的圆底烧瓶倒置于盛水的水槽中,充分溶解后,若气体没有外逸,则三个烧瓶中溶液的物质的量浓度之比是( )
A.2:2:3 B. 2:2:1 C.3:3:2 D. 1:1:1
16. 在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2![]() N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色
②平均摩尔质量 ③质量 ④压强 ⑤密度中不变的是(
)
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色
②平均摩尔质量 ③质量 ④压强 ⑤密度中不变的是(
)
A.③⑤ B.③④ C.②④ D.①③
17.人体正常的血红蛋白中应含Fe2+,若误食亚硝酸盐,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒,而服用维生素C,则可解除亚硝酸盐中毒。下列叙述正确的是( )
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe2+还原为Fe3+ D.亚硝酸盐被氧化
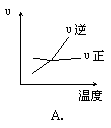
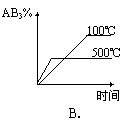
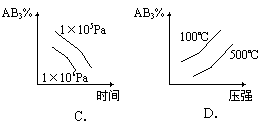
18. 对于可逆反应 2AB3(g) ![]() A2(g) + 3B2(g)(正反应为吸热反应),下列图像正确的是
A2(g) + 3B2(g)(正反应为吸热反应),下列图像正确的是
 |  |  | |||
19. 若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A 2ω1=ω2 B 2ω2=ω1 C ω2>2ω1 D ω1<ω2<2ω1
20.天平两托盘上各放置一只盛有等物质的量浓度、等体积的稀H2SO4的烧杯,天平处于平衡。向一只烧杯中投入金属铁,向另一只烧杯中投入质量相同的金属锌,反应停止后,天平仍保持平衡状态。则可能是( )
A.投入的两种金属均过量 B.投入的两种金属均不足量
C.投入的锌过量,铁恰好反应 D.投入的铁过量,锌恰好反应
三、 填空题(本题共24分)
21.(6分)氮气的熔沸点很低,其原因是 ;氨气是一种易液化的气体,其原因是 ;工业上浓硝酸可用铁或铝制容器盛装和运输,其原因是 ;实验室中浓硝酸保存在
中并放在 地方,其原因是 。
22.(6分)配平下列化学方程式并标出电子转移方向和数目,指出氧化剂和氧化产物。
(1)___KMnO4 + ___K2SO3 + ___H2O — ___MnO2œ + ___K2SO4+ ___KOH
氧化剂 ;氧化产物 。
(2)___KClO3 + ___HCl — ___KCl + ___Cl2› + ___H2O
氧化剂 ;氧化产物 。
23.(5分)已知反应CaCO3![]() CaO+CO2↑在不同温度下,CO2的平衡压强如下表:
CaO+CO2↑在不同温度下,CO2的平衡压强如下表:
| 温度/℃ | 550 | 650 | 750 | 850 | 897 |
| 压强/Pa | 5.32×10 | 9.17×102 | 8.37×103 | 4.94×104 | 1.01×105 |
根据上述数据,完成下列填空:
(1)若升高原CaCO3分解平衡体系的温度,同时给反应容器加压,则原平衡
A.向逆反应方向移动 B.向正反应方向移动 C.不移动盘 D.无法确定平衡移动方向
(2)在一个与外界不能进行热交换的密闭容器中,足量的CaCO3在850℃时建立了分解平衡。若将该容器的容积扩大为原来的2倍,当重新达到平衡时容器内的温度将 ,CaCO3的分解率将 ,CO2的平衡压强将
4.94×104 Pa(填>、=、<),其理由是 。
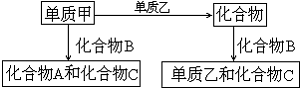
24.(7分) A、B、C是中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系(已知NH3和NxOy在一定条件下发生下列反应:NH3+NxOy→N2+H2O):
|
|
据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是 。(用A、B、C字母填写)
(2)单质乙必定是 (填"金属"或"非金属"),其理由是 。
(3)单质乙的分子式可能是 或 ,则化合物B的分子式是 或 。
四、 实验题(本题共14分)
25.(4分)下列气体:Cl2、O2、N2、HCl、NO2、NO、CO2、CO、SO2、H2、NH3。其中:
(1)可用排水法收集的有 。
(2)可有向上排气法收集的有 。
(3)在空气中能燃烧的有 。
(4)不能用浓硫酸干燥的有 。
26.
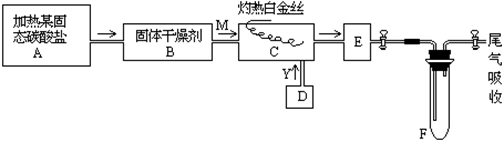 |
(10分)某化学课外小组所做实验的示意图如下:
上图中‘→’表示气体流向,M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生。实验所用的物质,只能由下列物质中选取:Na2CO、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。
据此实验,完成下列填空:
(1)A中所用装置的主要仪器有 。
(2)B中所选的干燥剂是 ,其作用是 。
(3)C中发生的主要反应的化学方程式是 。
(4)制取Y气的D装置所用的主要仪器是 ,制取Y气的化学方程式是 。
(5)当F中充有一定量气体后,D停止送气,A停止加热,并立即关闭两个活塞,这时若将F浸入冰水中,可看到F中的现象是 ,其原因是 。
五、 计算题(本题共12分)
27.(4分)32g铜片与100mL浓硝酸恰好完全反应,产生标准状况下的气体11.2L,计算:
(1) 原硝酸溶液的物质的量浓度。
(2) 若生成的气体与氧气混合通入水中,完全转化为硝酸,需要标准状况下的氧气多少L ?
28.(8分)Ⅰ. 恒温、恒压下,在一个可变容积的容器中发生如下发应:A(g)+B(g)![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)
(A)大于2 mol (B)等于2 mol
(C)小于2 mol (D)可能大于、等于或小于2mol
作出此判断的理由是 。
(3)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(A)a<b (B)a>b (C)a=b (D)不能比较a和b的大小
作出此判断的理由是 。
发表于《考试报》高二化学版第9期(2003年11月)
高二年级上学期期中考试化学参考答案
一、选择题
1.C 汽油的不完全燃烧生成CO气体,汽缸运动摩擦产生电火花使氮气和氧气反应生成NO气体,含铅汽油燃烧产生铅的化合物。这三种物质都是大气污染物。
2.A 降低温度颜色变浅,说明平衡向正反应方向移动;而降低温度,平衡又向放热反应方向移动。综合两方面,正反应是放热反应。
3. B 王水是浓硝酸和浓盐酸按体积比1:3混合而成的液体;硝铵即硝酸铵;漂白粉是次氯酸钙和氯化钙的混合物;氨水是氨气的水溶液。
4.A 中学化学中能使湿润的红色石蕊试纸变蓝的气体一定是氨气,则另一种气体一定是氯化氢气体,故为氯化铵。
5.C 合成氨气,利用氮气的氧化性;做制冷剂利用氮气的沸点很低;制硝酸一般以氨气为原料;作保护气利用了氮气难以与其他物质发生反应即不活泼性。
6.B 催化剂只能同等程度改变正、逆反应速率,缩短可逆反应达到平衡所需的时间,而不能改变化学平衡。
7.D 根据用不同反应物和生成物表示同一反应的反应速率时,速率数值不一定相等,但速率之比等于反应方程式中各物质的化学计量数之比求得。
8.B
9.B N60是氮元素的一种新单质,而非化合物,故与N2互为同素异形体;同位素反映的是原子之间的关系;由于N60分子结构与C60相似,只存在氮氮单键和双键,而N2中存在氮氮三键,故后者更稳定。
10.D 亚硝酸既然作氧化剂,氮元素的化合价一定降低,而选项中氮元素化合价低于+3价的只有N2O。
二、选择题
11.B A、C两组离子在溶液中可以大量共存;D组离子因发生沉淀反应不能共存;B组中的氢离子和硝酸根离子组成硝酸,有强氧化性,而碘离子有还原性,二者发生氧化还原反应不能大量共存。在溶液中有硝酸根离子时,一定要注意溶液的酸碱性,若为酸性,则一定要考虑氧化性。
12.A 假设平衡时混合气体体积为1L,则氨气占0.25L,根据合成氨反应前后气体体积差是2体积,而生成的氨气也是2体积,从而得反应前后气体体积减少了0.25L,则反应前气体总体积应为1.25L,故为1:5。
13.B 判断离子方程式正误,应从书写离子反应方程式的原则,即是否符合客观事实、是否满足质量守恒、是否满足电荷守恒(若为氧化还原反应,还应满足电子守恒)等几方面分析。A选项不满足电子守恒;C选项的反应不在溶液中进行;D选项不符合客观事实。
14.B 根据质量守恒定律及关系式M=m/n,混合气体质量不变,平均相对分子质量变小,只能是物质的量增大,即平衡向气体总体积增大的方向移动,故生成物都应是气体。
15.D
由气体的物质的量和溶液体积之间的关系,即cA=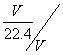 ,容易得到盐酸和氨水的浓度相等,而NO2虽然只有2/3体积转化为硝酸,但溶液的体积也只有烧瓶体积的2/3,另外的1/3是反应生成的NO气体。故浓度比是1:1:1。
,容易得到盐酸和氨水的浓度相等,而NO2虽然只有2/3体积转化为硝酸,但溶液的体积也只有烧瓶体积的2/3,另外的1/3是反应生成的NO气体。故浓度比是1:1:1。
16.A 由于温度升高,平衡移动,所以气体颜色、物质的量均改变,故平均摩尔质量和压强都将改变。由于质量守恒及烧瓶体积不变,所以质量和密度不变。
17.B 由题给条件知:亚硝酸盐在反应中表现出氧化性,故解毒应用还原剂。
18.BD 该可逆反应的特点是气体总体积减小的反应,又是吸热反应。升高温度,平衡向正向移动,正反应速率应大于逆反应速率但都增大,反应物的百分含量减少,故A选项错误,B选项正确;压强增大,平衡向逆向移动,反应物的百分含量增大,故C选项错误,D选项正确。
19.C
由物质的量浓度和溶质质量分数的换算式:c=![]() ,得
,得![]() ,根据氨水的浓度越大密度越小,即
,根据氨水的浓度越大密度越小,即![]() 大于
大于![]() ,求出
,求出![]() 之比,从而得出正确结论。
之比,从而得出正确结论。
20.AD 解决天平平衡问题的一般方法是求出两烧杯中净增加的质量。当两种金属质量相等且均过量时,硫酸完全反应,消耗的H+的量相等,产生氢气的量也相等,两烧杯净增加的质量相等,故仍平衡,A正确;由相等量稀硫酸与铁和锌完全反应,消耗锌的质量大,可知D也正确。
三、填空题
21.氮气分子是非极性分子,分子间作用力弱;氨分子是强极性分子,分子间作用力较强;浓硝酸与铁或铝发生反应,在金属表面生成一层致密的氧化膜,保护金属不与硝酸继续反应;棕色试剂瓶;冷暗;硝酸见光或受热会分解。
22.(1)2、3、1、2、3、2;氧化剂是KMnO4 ;氧化产物是K2SO4 。(2)1、6、1、3、3;氧化剂是KClO3 ;氧化产物是Cl2 (电子转移方向和数目略)。
23.(1)D。 (2)降低;增大;小于;体积增大,压强减小,平衡向正反应方向移动,碳酸钙分解率增大,需吸收能量,所以温度降低,且压强低于850℃时的压强。
24.(1)A、B。 (2)非金属;因为A+B→乙+C,且乙为单质,可知乙元素在A,B中分别呈正、负价,所以乙是非金属。 (3) N2,NH3 (或: S,H2S)
四、实验题
25.(1)O2、N2、NO、CO、H2 。 (2)Cl2、O2、HCl、NO2、CO2、SO2 。 (3)CO、H2 。 (4)NH3。
26.(1)大试管、铁架台(附铁夹)、酒精灯、单孔胶塞和玻璃导管。 (2)碱石灰, 既除去水气也除去CO2。(3)4NH3(g)+5O2(g)=4NO(g)+6H2O(g)。 (4)铁架台、分液漏斗、平底烧瓶(或锥形瓶)、胶塞、导管;2Na2O2+2H2O=4NaOH+O2↑。(5)颜色变浅;因为反应2NO2 (g) ![]() N2O4(g)是放热反应,降低温度时平衡向正方向移动,红棕色的NO2部分转变为无色的N2O4,故颜色变浅。
N2O4(g)是放热反应,降低温度时平衡向正方向移动,红棕色的NO2部分转变为无色的N2O4,故颜色变浅。
五、计算题
27.解:(1)根据题给条件,反应生成的气体应该是NO和NO2的混合气体,由反应前后原子守恒知,硝酸中的氮原子分别转移到硝酸铜和氮的氧化物中,故
![]() n(HNO3)=n(Cu)+n(NOx)=
n(HNO3)=n(Cu)+n(NOx)=![]() =1.5mol;所以c(HNO3)=15mol·L-1。
(2)根据铜原子将电子转移给氮原子,而氮原子又将电子转移给氧原子,整个过程电子守恒,可计算出氧气在标准状况下的体积:
=1.5mol;所以c(HNO3)=15mol·L-1。
(2)根据铜原子将电子转移给氮原子,而氮原子又将电子转移给氧原子,整个过程电子守恒,可计算出氧气在标准状况下的体积:![]() ,V(O2)=5.6L。
,V(O2)=5.6L。
28. (1)(1-a)。 (2)2 ; 3-3a ; D;若3a>1,B的物质的量小于2mol;若![]() ,B的物质的量等于2mol;若3a<1,B的物质的量大于2mol。
(3)
,B的物质的量等于2mol;若3a<1,B的物质的量大于2mol。
(3)![]() 。 (4)B 因为(4)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(4)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
。 (4)B 因为(4)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(4)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
发表于《考试报高二化学版》第9期(2003年11月)