高二年级上学期期中考试化学试题
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 Ba:137
第I卷(选择题,共72分)
一、选择题(本题包括5小题,每小题4分共20分,每小题只有一个选项符合题意)
1、下列各物质既是电解质,同时又能导电的是 ( )
A. Cu B. 熔化的NaCl C. 98%的浓H2SO4 D. 液态氯化氢
2、将pH试纸用蒸馏水湿润后,去测定某溶液的pH值,该溶液的pH值将会 ( )D
A.偏高 B.偏低 C.不变 D.上述三种情况均有可能
3、下列事实不能用勒夏特列原理解释的是 ( )
①氮气和氢气合成氨需要较高温度(约500℃)
②饱和NaCl溶液中通入HCl气体有晶体析出
③工业上制硫酸,利用催化剂有利于SO3的生成
④用排饱和食盐水收集Cl2
A.①③ B.②④ C.①③④ D.①②③④
4、以下关于溶液酸碱性的判断正确的是 ( )
A.pH为7的溶液一定呈中性
B.某溶液中C(H+)>C(OH-),溶液呈酸性
C.某盐溶液呈酸性,该盐一定是由强酸和弱碱生成的盐
D.在25℃,任何物质的水溶液中由水所电离生成的C(H+)·C(OH-)是个常数
5、根据酸碱质子理论:凡是能给出质子(即氢离子)的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。按照此理论,下列粒子属于两性物质的是 ( )C
A.NO2- B.H3O+ C.H2PO4- D.NH4+
二、选择题(本题包括8小题,每小题4分共32分,每题有一个或两个选项符合题意)
6、下列方程式中能表示水解反应是 ( )
A.NH4NO3=NH4++NO3-
B.HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
C.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
D.Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
7、下列物质分别与等量盐酸恰好完全反应,所得溶液溶质的物质的量浓度最大的是 ( )
A.Ca B.CaO C.Ca(OH)2 D.Ca(HCO3)2
8、下列各组离子中,能在水溶液中大量共存且溶液显酸性的是 ( )
A. Al3+、HCO3-、Na+ B. Al3+、Mg2+、SO42-
C.AlO2-、HCO3-、Na+ D. Al3+、AlO2-、Cl-
9、相同温度下,在水中分别加入下列物质,能使水的电离程度增大的是 ( )
A. H2SO4 B. NaHSO4 C. Na3PO4 D. NH4Cl
10、在25℃,某水溶液中由水所电离生成的C(H+)和C(OH-)的乘积为1X 10-18,下列说法正确的是 ( )
A.该溶液的pH一定是9 B. 该溶液的pH可能是5
C.该溶液的pH不可能是7 D. 不会有这样的溶液
11、下列各组中均是两瓶无标签的无色溶液,不使用其他试剂,通过相互反应能鉴别出来的是 ( )
①NaOH和Al2(SO4)3 ②Na2CO3和稀HCl ③Ba(OH)2和H3PO4 ④HCl和NaAlO2
A.只有①②③ B.只有②③④ C.只有①④ D.①②③④
12、可逆反应aA+bB![]() cC+dD+Q,(A、B、C、D都是气体)如图所示,下列叙述正确的( )
cC+dD+Q,(A、B、C、D都是气体)如图所示,下列叙述正确的( )
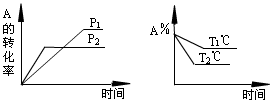
A.p1<p2,a+b<c+d,T1℃<T2℃,Q为负值
B.p1>p2,a+b>c+d,T1℃>T2℃,Q为正值
C.p1<p2,a+b<c+d,T1℃>T2℃,Q为正值
D.以上答案均不对
13、合成氨反应中,若达到平衡时氨气占平衡混合气体体积的25%,且温度、容积不变,则平衡时压强为起始时压强的 ( )
A.1.25倍 B.80% C.75% D.25%
三、选择题(本题包括5小题,每小题4分共20分,每小题只有一个选项符合题意)
14、将 0.2 mol·L-1HCN溶液和 0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A.c(HCN)<c(CN) B. c(Na+) <c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D. c(HCN)+c(CN-)= 0.1 mol·L-1
15、不能证明醋酸是弱电解质的事实是 ( )A
A.中和1L0.1mol/L的CH3COOH 溶液需要0.1mol/L NaOH溶液1L
B.0.1mol/L CH3COONa溶液的pH大于7
C.pH=3的CH3COOH 溶液加水稀释到原体积的10倍时,pH小于4
D.0.1mol/L的CH3COOH溶液的pH=3
16、下图中,纵坐标为沉淀物的物质的量,横坐标为向某溶液中加入反应物的物质的量,下列(1)(2)(3)(4)反应对应的图形分别是 ( )
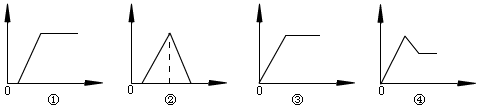
(1)向饱和明矾溶液中滴入小苏打溶液至过量
(2)向含少量NaOH的NaAlO2溶液中逐滴加入盐酸至过量
(3)向含少量KOH的KAlO2溶液中逐滴加入AlCl3至过量
(4)向MgCl2和AlCl3的混合溶液中逐滴加入NaOH溶液至过量
A.①②③④ B.④③①② C.③②①④ D.①②④③
17、![]() 保持相同温度时,可逆反应2A(g)+ B(g) 2C(g)在1×105Pa达到平衡时和在1×106Pa达到平衡时,其逆反应速率前者与后者相比 (
)
保持相同温度时,可逆反应2A(g)+ B(g) 2C(g)在1×105Pa达到平衡时和在1×106Pa达到平衡时,其逆反应速率前者与后者相比 (
)
A.大于 B.小于 C.等于 D.不能肯定
18、在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:
![]() 达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是 ( )
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是 ( )
A. ![]()
B. ![]()
C. ![]()
D. ![]()
第Ⅱ卷(非选择题,共78分)
四、(本小题包括2小题,共20分)
19、有一学生在实验室测定某溶液的pH值,实验时,他先用蒸馏水湿润pH试纸,然后用洁净干燥的玻棒蘸取试样进行测定。
(1)该学生的操作是 (填“正确”或“错误”)其理由是
。
(2)如不正确,请分析是否一定有误差:
。
(3)若用此法分别测定CH![]() 相等的HCl和HAc溶液的pH值,误差较大的是 ,
相等的HCl和HAc溶液的pH值,误差较大的是 ,
原因是: .
20、某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A、在250mL的容量瓶中定容成250mL烧碱溶液
B、用移液管移取25mL烧碱溶液于锥形瓶中滴加几滴甲基橙指示剂
C、在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解
D、将物质的量浓度为Mmol·L-1的标准的H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数V1mL
E、在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度数为V2mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写):_____→_____→_____→_____→_____
(2)向滴定管中装入标准液后,液面应调整到的位置一般为:________________。
(3)操作E中在锥形瓶下垫一张白纸的作用是__________________。滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视___________。
(4)下列操作可能使测定结果偏低的是___________。
A、酸式滴定管在装液前未用标准H2SO4溶液润洗2次~3次
B、开始实验时,酸式滴定管尖嘴部分有气泡,在滴定过程中,气泡消失
C、滴定过程中,锥形瓶内溶液颜色变化由黄色变橙色,但立即又变为黄色,此时即记下滴定管液面所示的刻度
D、达到滴定终点时,俯视溶液凹面最低点读数(滴定前读数准确)
E、盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗
(5)如果所用酸式滴定管为50mL滴定管,实验完毕后,酸式滴定管中所剩标准液体积为___________。
A、V2mL B、(50-V2)mL
C、大于(50-V2)mL D、小于(50-V2)mL
(6)该烧碱样品中的纯度计算为______________________。
五、(本题包括2小题,共24分)
21、在一定温度下,把
2mol SO2和1mol O2通入一个容积固定的密闭容器里,发生如下反应:![]() 。当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的质量分数仍跟上述平衡的完全相同。请填写下列空白:
。当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的质量分数仍跟上述平衡的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=___________。
(2)若a=0.5,则b=___________,c=___________.
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)___________,___________。
22.今有①CH3COOH、②HCl、③H2SO4 三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①=③>②
E.①>②=③ F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是 A 。
(2)当它们的物质的量浓度相同时,其pH的关系是A 。
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为 H 。
(4)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 B 。
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 E 。
(6)当它们pH相同、体积相同时,同时加入锌,则开始时反应速率 C ,若产生相同体积的气体(相同状况),所需时间 F 。
(7)将pH相同的三种酸均稀释10倍后,pH关系为 F 。
六、(本题包括2小题,共16分)
23、(1)![]() 溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为有
溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为有![]() 的水溶液中存在如下平衡:
的水溶液中存在如下平衡:
![]()
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法:①___________,
②_______________。
(2)在![]() 的平衡体系中,加入
的平衡体系中,加入![]() 构成氧气,当平衡发生移动后,
构成氧气,当平衡发生移动后,![]() 中
中![]() 的含量_________(填增加、减少或不变),其原因是__________。
的含量_________(填增加、减少或不变),其原因是__________。
24、有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状态下对空气的相对密度为1.103。且有下列转化关系:
①A+NaOH→D+H2O;②B![]() A+H2O;③C+NaOH(适量)→B+NaCl;
A+H2O;③C+NaOH(适量)→B+NaCl;
④E+H2O→NaOH+F;⑤C+D+H2O→B+……
回答下列问题:
(1)化学式:A__________,B__________,C__________,D__________。
(2)写出C溶液与D溶液反应的化学方程式:_____________________。
(3)写出4molC和6molE在水溶液中发生反应的化学方程式(写出一个总反应的化学方程式):____________________________________。
七、(本题包括2小题,共18分)
25、50mL0.1mol/LBaCl2与100mL0.75mol/L H2SO4溶液混合,求:
⑴产生沉淀多少克?
⑵反应后溶液的pH为多少?
26、Ⅰ、恒温、恒容下,在一个密闭的容器中发生如下反应:
![]() A(g)+ B(g) 2C(g)
A(g)+ B(g) 2C(g)
(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为 mol;
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol;此时C的质量分数与(1)比较 (填相等、大于或小于);
(3)若开始时,放入x mol A,2 mol B和2 mol c到达平衡后,A和C的物质的量分别是y mol和3a mol,则x = mol, y = mol;开始时的反应将向 (选填一个编号) 。
(甲)正向移动 (乙)逆向移动
(丙)可能正向,可能逆向移动 (丁)平衡不移动
作出此判断的理由是 。
![]() Ⅱ、若在相同条件下的反应为:A(g)+ B(s) 2C(g),开始时加入1 mol A、1 mol B,反应达平衡时生成C为0.2 mol,则按下列配比加入后,达平衡时生成C的物质的量仍为0.2 mol的是
Ⅱ、若在相同条件下的反应为:A(g)+ B(s) 2C(g),开始时加入1 mol A、1 mol B,反应达平衡时生成C为0.2 mol,则按下列配比加入后,达平衡时生成C的物质的量仍为0.2 mol的是
A. 2 mol C B. 1 mol A + 0.5 mol B
C. 0.5 mol A + 0.5 mol B + 1 mol C D. 2 mol A + 2 mol B
![]()
 高二化学期中考试答题卷
高二化学期中考试答题卷
第I卷(选择题,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共78分)
四、(本小题包括2小题,共20分)
19、(1) , 。
(2) .
(3) , .
20、(1)(用字母填写):_____→_____→_____→_____→_____
(2)________________。
(3) ,___________。
(4)___________。
(5)___________。
(6)______________________。
五、(本题包括2小题,共24分)
21、(1)___________。
(2)___________, ___________.
(3)___________,___________。
22、(1) A 。(2)A 。(3) H 。(4) B 。
(5) E 。(6) F , 。(7) F 。
六、(本题包括2小题,共16分)
23、 (1) ① ___________,② ________________。
(2) _________ , 。
24、 (1) A__________,B__________,C__________,D__________。
(2) 。
(3) 。
七、(本题包括2小题,共18分)
25、
26、Ⅰ、(1) mol;(2) mol; ;
(3)x = mol, y = mol; ,
。
Ⅱ、 .
答案:
第I卷(选择题 )
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | A | B | C | CD | A | B | CD |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BC | D | A | B | D | A | C | B | D |
第Ⅱ卷(非选择题)
四、(本小题包括2小题 )
19、答案: (1)错误, pH试纸用蒸馏水湿润,稀释了溶液,减小了原溶液的浓度.(2)可能引起误差,但对中性溶液pH不变.(3)HCl,HAC是弱电解质,加水后电离度增大.
20、答案:(1)CABDE
(2)零刻度或零刻度稍下的某一刻度
(3)便于准确判断滴定终点时溶液的颜色变化情况;锥形瓶中溶液颜色的变化
(4)CD (5) C (6)![]()
五、(本题包括2小题 )
21、答案:(1)c=2 (2)b=0.25; c=1.5 (3)c+a=2; 2b+c=2
22.
答案:(1) A (2) A (3) H (4) B (5) E
(6) C , F (7) F
六、(本题包括2小题 )
23、答案:
(1)(1)加水 (2)加入![]() 溶液
溶液
(2)增加, 在![]() 与
与![]() 反应生成
反应生成![]() 的同时,
的同时,![]() 又分解成
又分解成![]() 。
。
24、答案:(1)A、Al2O3;B、Al(OH)3;C、AlCl3;D、NaAlO2
(2)AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
(3)4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+3O2↑+12NaCl
七、(本题包括2小题 )
25、(1)1.165g,(2)0
26、答案:(1)1-a;(2)3a,相等(3)2 ,3(1-![]() ),丙.a的具体数值未确定;ABC.
),丙.a的具体数值未确定;ABC.
0.2g 1.59g