高二期中考试化学试卷
(卷Ⅰ)
姓名: 班级: 学号: 成绩:
一、选择题(每小题只有一个正确答案)
1、大气或水污染时,可引起人的牙齿和骨骼变酥,引起这种污染的元素是: ( )
A、F B、Cl C、Br D、I
2、将如下卤化物跟浓H2SO4放在烧瓶中共热,可以制备得到纯净卤化氢气体的是( )
A、NaF B、NaCl C、NaBr D、NaI
3、将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是: ( )
A、NaOH浓溶液 B、NaCl浓溶液 C、沸水 D、冷水
4、下列各组物质的晶体中,化学键类型和晶体类型都相同的是: ( )
A、SO2和SiO2 B、NaCl和HCl C、CCl4和KCl D、CO2和H2O
5、0.096kg碳完全燃烧生成二氧化碳气体放出3143.4kJ热量,以下热化学方程式的表示中正确的是: ( )
A、C(s) + O2(g) =CO2(g);ΔH = -392.9kJ/mol
B、C(s) + O2(g) =CO2(g);ΔH = -196.5kJ/mol
C、C(s) + O2(g) =CO2(g);ΔH = +392.9kJ/mol
D、C + O2 =CO2;ΔH = -392.9kJ/mol
6、下列各组中的离子,因发生氧化还原反应而不能大量共存的是: ( )
A、Fe3+ K+ OH- Cl- B、SO42- Fe2+ Cl- I-
C、S2- Cl- NO3- H+ D、Al3+ Ag+ Na+ Cl-
7、现有一种含Ag+、Al3+、Mg2+、Ba2+的混合液,要使上述四种离子利用沉淀反应逐一分离出来,加入试剂(溶液)的顺序依次是: ( )
A、NaOH、NaCl、HCl、Na2SO4 B、HCl、NaOH、Na2SO4、NaCl
C、Na2SO4、NaOH、NaCl、HCl D、NaCl、Na2SO4、NaOH、HCl
8、将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和蒸馏水混合,要使混合溶液中K+浓度为0.1 mol/L,Al3+浓度为0.1 mol/L,SO42-浓度为0.2mol/L,则所取K2SO4溶液、Al2(SO4)3溶液和蒸馏水三者的体积比是: ( )
A、2∶1∶2 B、1∶1∶2 C、2∶1∶1 D、1∶1∶1
9、Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4∶1,则溶液中NaCl与NaClO的物质的量之比为: ( )
A、11∶2 B、5∶1 C、1∶1 D、9∶4
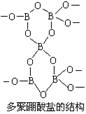 10、有一种多聚硼酸盐为无限空间网状结构,右图为其结构单元示意图。其结构的基本单元可表示为(B5On)m-,则m、n的值分别为
10、有一种多聚硼酸盐为无限空间网状结构,右图为其结构单元示意图。其结构的基本单元可表示为(B5On)m-,则m、n的值分别为
( )
A、3,9 B、2,4
C、2,5 D、3,6
二、选择题(每小题有一至两个正确答案)
11、在FeCl3和BaCl2的混合溶液中通入SO2气体,观察到有白色沉淀生成,此沉淀是: ( )
A、BaSO4 B、BaSO3 C、S D、FeS
A、3∶2 B、3∶1 C、2∶1 D、1∶1
13、将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是: ( )
A、CO2 B、NO2 C、H2S D、NH3
14、两种金属组成的合金25g与Cl2完全反应后,消耗Cl2 35.5g,则合金的可能组成是:
( )
A、钙和铜 B、铁和铝 C、钠和镁 D、铜和锌
15、已知氯化碘(ICl)的性质类似于卤素,有很强的化学活性。ICl跟Zn、H2O分别发生如下反应:2ICl + 2Zn = ZnCl2 + ZnI2,ICl + H2O = HCl + HIO。下列叙述正确的是:( )
A、在H2O和ICl的反应中,ICl既是氧化剂又是还原剂
B、在H2O和ICl的反应中,ICl既不是氧化剂又不是还原剂
C、在Zn和ICl的反应中,ZnI2 既是氧化产物又是还原产物
D、在Zn和ICl的反应中,ZnCl2 既不是氧化产物又不是还原产物
16、将淀粉碘化钾混合溶液装在羊皮纸制成的袋中,将此袋下半部浸泡在盛有蒸馏水的烧杯里,过一段时间后取烧杯中的液体进行实验,下列现象能证明羊皮纸袋一定有破损的是: ( )
A、加入NaI溶液不变蓝色 B、加入溴水变蓝色
C、加入AgNO3溶液产生黄色沉淀 D、加入碘水变蓝色
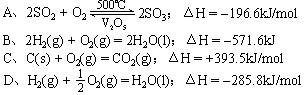 |
17、下列热化学方程式书写正确的是: ( )
18、下列反应的离子方程式书写正确的是: ( )
A、向氢氧化钠溶液中通入少量CO2:OH- +CO2 = HCO3-
B、向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3+ + H2S = Fe2+ +S↓+2H+
C、硝酸铝溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO2- + 4NH4+ + 2H2O
D、用氨水吸收少量SO2:2NH3•H2O +SO2 = 2NH4+ + SO32- +H2O
19、某工厂甲、乙两车间分别排放出来的污水中各含大量的Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-中的四种,若各自单独排放,会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水pH>7,则乙车间污水中含有的四种离子可能是: ( )
A、Ag+、SO42-、Fe3+、NO3- B、Ag+、Fe3+、NO3-、Na+
C、Na+、SO42-、Cl-、OH- D、Ag+、Ba2+、Fe3+、NO3-
20、下列关于晶体的说法正确的是: ( )
A、分子晶体的熔点一定比金属晶体的低
B、原子晶体的熔点一定比金属晶体的高
C、在晶体中只要有阳离子就一定有阴离子
D、在晶体中只要有阴离子就一定有阳离子
高二期中考试化学试卷
(卷Ⅱ)
姓名: 班级: 学号: 成绩:
选择题答案栏:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填充题
21、写出下列离子方程式:
⑴CuSO4溶液吸收H2S气体:
⑵SO2气体通入Br2水中:
⑶(NH4)2SO4溶液和Ba(OH)2溶液混合共热:
⑷含1mol Na2S的溶液、含1mol Na2SO3 的溶液和含3mol H2SO4的溶液混合:
22、有以下物质:
①干冰 ②硫黄 ③金刚石 ④晶体硅 ⑤金刚砂(碳化硅)
⑥三氯甲烷 ⑦过氧化钠 ⑧二氧化硅 ⑨铝 ⑩氯化铵
⑴固态时属于分子晶体的物质是(填编号): ;
固态时属于原子晶体的化合物是(填编号): 。
⑵写出含非极性键的离子化合物的化学式: ;
写出由极性键结合而成的非极性分子的电子式: ;
写出上述两物质相互反应的化学方程式,并用双桥法表示电子转移的方向和数目:
。
⑶③、④、⑤熔点从高到低的顺序是(填编号): 。
23、过氧化氢(H2O2)俗名双氧水,医疗上可作外科消毒剂。
⑴向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水具有 性;
⑵将双氧水加入酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出
性;
⑶久置的油画其白色部分(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,则恢复原貌过程中发生反应的化学方程式: ;
⑷如果将9.60×10-4 molAO4-离子在溶液中还原成较低价态,需用0.100 mol/L H2O2溶液24.0mL,则被还原后A的最终价态为: 。
四、推断题
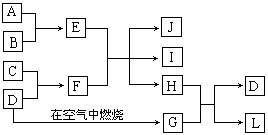 |
24、下图每一方框中的字母代表一种反应物或生成物:
已知产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
⑴写出G的化学式: ,H的电子式:
⑵写出J受热分解反应的化学方程式:
⑶写出E溶液和F溶液反应的离子方程式:
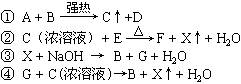 |
25、有A、B、C、D、E、F、G七种化合物和单质X,它们存在下列关系:
已知A、B都是含有同一种金属元素的盐,X在常温下是气体,D的水溶液中加入BaCl2溶液会产生不溶于稀硝酸的白色沉淀,E是黑色固体。
⑴写出下列物质的化学式:
A: B: X:
⑵写出反应①②的化学方程式及反应③的离子方程式:
①
②
③
五、实验题
26、⑴写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并用单桥法表示出电子转移的方向和数目:
 |
⑵试用下图所列各装置设计一个实验,验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号): →
→ → 。
⑶实验室可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色,则A瓶的作用是 ,B瓶的作用是 ,C瓶的作用是 。
⑷装置②中所加的固体药品是 ,可确证的产物是 。
⑸装置③中所盛溶液是 ,可验证的产物是 。
⑹如果将仪器按④①②③的顺序连接,则可以检验出的产物是 ,不能检验出的产物是 。
六、计算题
27、有pH=13的Ba(OH)2和NaOH的混合溶液100mL,取出25mL用0.05mol/L 的H2SO4进行滴定,当滴定到沉淀不再增加时,所用H2SO4的体积是滴定终点时所用H2SO4溶液体积的一半,求:
⑴恰好完全沉淀时溶液的pH值;
⑵原混合溶液中Ba(OH)2、NaOH的物质的量浓度。