高二期终考试化学试卷
第I卷(选择题,共72分)
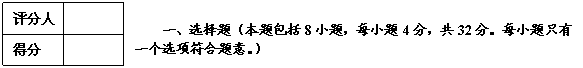 可能用到的相对原子质量:H 1 C 12 Br 80 O 16 Na 23 Mg 24 Al
27 Fe 56
可能用到的相对原子质量:H 1 C 12 Br 80 O 16 Na 23 Mg 24 Al
27 Fe 56
 |
1、按系统名法, 的正确名称是
A.3,3-二甲基异己烷 B.1,1,2,2-四甲基丁烷
C.2,3,3-3甲基戊烷 D.2,3,3-三甲基戊烷
2、下列各烃中, 一卤代物有两种, 二卤代物则有四种的是
A.C2H6 B.C3H8 C.CH3CH(CH3)CH3 D.CH3CH2CH2CH3
3、气体A和B的通式分别为CnH2n-2和CnH2n+2, 在催化剂存在时, 使200 mL A和B的混
合气体加氢需100 mL H2(同温同压), 则最初混合气体中A和B的体积比为
A.1:1 B.1:2 C.1:3 D.3:1
4、要鉴别己烯中是否混有少量甲苯, 正确的实验方法是
A.先加足量的酸性KMnO4溶液, 然后再加入溴水
B.先加入足量溴水, 然后再加入酸性KMnO4溶液
C.点燃这种液体, 然后观察火焰的明亮程度
D.加入浓H2SO4与浓HNO3后加热
5、某烃的分子式为C10H14,不能使溴水褪色,但可使酸性KMnO4溶液褪色。若此烃分子结构中只含一个烷基,则此烷基的结构有
A.2种 B.3种 C.4种 D.5种
6、A、B两种烃组成的混合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧 消耗氧气的量为一恒量:那么A、B两种烃可能是:①互为同分异构体;②互为同系物;③具有相同的最简式;④含碳的质量分数相同,正确的结论是
A.①②③④ B.①③④ C.②③④ D.③④
7、二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库等中的致冷剂。试判断二氟甲烷的结构简式
A.有4种 B.有3种 C.有2种 D.只有1种
8、一种气态烷烃和气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加了8.4g,组成该混合气体的可能是
A.乙烯和乙烷 B.乙烯和甲烷
C.丙烯和乙烷 D.丙烯和甲烷

9、铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减
少,溶液呈蓝色,该盐可能是
A.FeCl3 B.Na2CO3 C.KNO3 D.FeSO4
10、下列说法正确的是
A.用75%的乙醇和浓硫酸的混合液,加热到170℃时可以制得乙烯气体
B.石油的分馏属物理变化而煤的干馏属化学变化
C.制乙炔气体和制氢气都可以用启普发生器
D.用pH试纸测定其溶液的pH值时,用玻棒把待测液滴在湿润的pH试纸上,然后用标准比色卡对比而得到pH值
11、用下列不同方法制取相同质量的Fe(NO3)3,消耗硝酸的量最少的是
A.Fe + HNO3(稀) B.FeO + HNO3(稀)
C.Fe(OH)3 + HNO3(稀) D.Fe3O4 + HNO3(稀)
12、将AlCl3溶液和NaOH溶液等体积混合得到的沉淀物和溶液中所含的铝元素的质量相等,则下则原AlCl3溶液和NaOH溶液的物质的量浓度之比可能是
A、 1:3 B、2:3 C、 1:4 D、2:7
13、反应:xA(气)+yB(气) ![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是( )
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是( )
A.x+y<z B.平衡向右移动
C.B的转化率升高 D.C的体积分数降低
14、阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2=2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发,下列叙述正确的是
A.此电池能发出蓝色火焰
B.H2为正极,O2为负极
C.工作时,电解液的pH不断减小
D.电极反应为:负极2H2+4OH—+4e—=4H2O ,正极O2+2H2O+4e-=4OH—
15、某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是: ①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(H+)一定增大
A.① B.①③ C. ①②④ D.①⑤
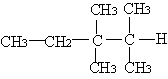
 16、如图所示,a的金属活动性比氢强;b为碳棒,关于此装置的下列叙述正确的是
16、如图所示,a的金属活动性比氢强;b为碳棒,关于此装置的下列叙述正确的是
A.碳棒上有气体放出,溶液pH增大
B.导线上有电流通过,电流方向是a极→电流表→b极
C.a为正极,b为负极
D.a极上发生氧化反应
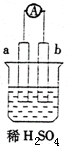
 17、如右图,液面上浮着一个空心铁球,数天后可观察到的现象是:
17、如右图,液面上浮着一个空心铁球,数天后可观察到的现象是:
①铁球表面出现红色锈斑
②铁球表面出现黑色锈斑
③量筒内水位下降
④量筒内水位上升
A.①③ B.①④ C.②③ D.②④
17、一定量的乙烯燃烧后的产物70.8g,当其产物缓慢通过无水CaCl2时,增重25.2g,则产物中CO2的质量为
A.17.6g B.45.6g C.30.8g D. 61.6g
18、在PH=1的溶液中能大量共存的离子组是
A.NH![]() 、Cl-、SCN-、Fe3+ B.K+、AlO2-、Cl-、Na+
、Cl-、SCN-、Fe3+ B.K+、AlO2-、Cl-、Na+
C.Al3+、Mg2+、SO![]() 、Cl- D.Cl-、NO
、Cl- D.Cl-、NO![]() 、Fe2+、Na+
、Fe2+、Na+
高二期终考试
化学试卷
| 题号 | 一、二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
|
|
|
|
|
|
第I卷 答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
 第II卷(非选择题,共78分)
第II卷(非选择题,共78分)

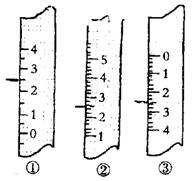
19、(2分)(1)右图分别是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是
A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为3.5 mL
D.②是温度计,读数为2.5℃
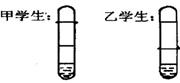 (2)(6分).有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝制废牙膏皮,各自设计了一种如图所示的装置,制取并收集一试管氢气。请回答:
(2)(6分).有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝制废牙膏皮,各自设计了一种如图所示的装置,制取并收集一试管氢气。请回答:
①哪个学生设计的装置比较合理?
②另一设计的装置不合理的原因是
③用较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该进行的操作是:
。
20、(14分) 现有废液,其中含有CuCl2、FeCl3、HCl。某课外活动小组计划用它得到纯净的FeCl2晶体,为此,设计如下实验方案:
第一步:用下图中的仪器和药品组装一套实验装置制取干燥纯净的CO,用CO还原Fe2O3粉末制取还原铁粉(制取CO的原理是:
![]()
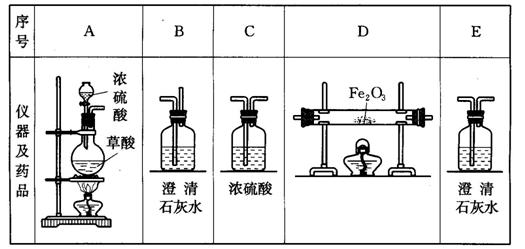
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右直接连接顺序(填仪器序号)是 → → → →
(2)正确的操作步骤中第一步应是: ,最后一步应是熄灭 处的酒精灯。
(3)装置B的作用是
装置E的作用是
第二步:将制得的还原铁粉放人原混合溶液中,制得纯净的FeCl2溶液。
(4)必须进行的操作是 。
第三步:得到纯净的FeCl2晶体。
(5)必须进行的操作是 。
21、(8分)下列各物质为中学化学中常见物质,其中甲、乙、丙、丁为中学化学中常见的单质,F为红棕色粉末,G即可与盐酸反应,又与氢氧化钠反应。各物质有如下图的转化关系。反应中生成的水和NaCl已经略去。
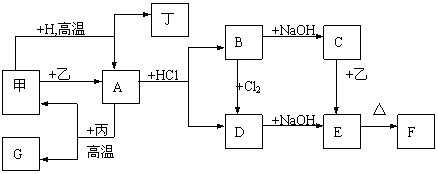 |
(1)写出下列物质的化学式:
A 、丁
(2)写出下列转化的反应方程式:
C+乙→E
A+丙→甲+G
22、(10分)已知HA是弱酸,常温下将0.010mol NaA和0.005molHCl溶于水,配制成0.5L混合溶液。判断:
(1)溶液中共有 种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是 和
(写化学式)
(3)溶滴中n(A‑)+n(OH‑) - n(H+)= mol。
(4)若上述溶液呈酸性,则溶液中各种微粒浓度(mol.L-1)由大到小的排列顺序是:
![]()
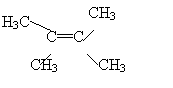
 23、(4分)有 机 物 A是 重 要 的 芳 香 烃,结 构 简 式为:
23、(4分)有 机 物 A是 重 要 的 芳 香 烃,结 构 简 式为:
,
![]()
![]()
![]() 其一溴代物共有 种。如果定义有机物的同系列是一系列结构式符合A [ W ]nB(其中n=0,1,2,3…)的化合物,式中A与B是任意一种基团;W为2价的有机基团,又称为该同系列的系差。有机物B的分子量为1686,B与A互为同系列,系差W为“
”,则系差数n值为 。
其一溴代物共有 种。如果定义有机物的同系列是一系列结构式符合A [ W ]nB(其中n=0,1,2,3…)的化合物,式中A与B是任意一种基团;W为2价的有机基团,又称为该同系列的系差。有机物B的分子量为1686,B与A互为同系列,系差W为“
”,则系差数n值为 。
24、(14分)3.6g某烃A的蒸气和Cl2发生取代反应,控制条件使其生成一氯代物,将反应生成的气体用0.1mol·L-1NaOH溶液中和,当完全反应时消耗NaOH溶液500mL, 则
(1)烃A的相对分子质量为
。
(2)实验测得烃A不能使酸性KMnO4溶液退色也不能使溴水退色,烃A的分子式
为
(3)写出符合分子式的所有同分异构体的结构简式:
(2)分子式为C6H12的某烯烃的所有的碳原子都在同一平面上,则该烯烃的结构简式为:
若分子式为C4H6的某炔烃中所有的碳原子都在同一条直线上,则该烃的结构简式为:

25. (8分)
取标准状况下CH4和过量O2的混合气体840mL,点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600g。计算:
(1)碱石灰吸收后所剩气体的体积(标准状况下)
(2)原混和气体中CH4跟O2的体积比。
26.(12分)在标准状况下进行甲、乙、丙三组实验:各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 0.255 | 0.385 | 0.459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
试回答:
(1)甲组实验中,盐酸 ,乙组实验中盐酸 (均填“过量”、“适量”或“不足量”)。
(2)计算出盐酸的物质的量浓度为____ __ mol.L-1
(3)要求出合金中镁、铝的质量分数,可作计算依据的数据是_____________ ___,铝的质量分数为___ _____。
(4)在丙组实验之后,向容器中加入一定体积1 mol.L-1的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,所加苛性钠溶液的体积为多少mL? 列式计算.
高二期终考试化学参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | B | C | B | C | B | D | B | AC |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | C | BD | D | D | D | AD | B | C |
19. (1) B (2分)
(2)①乙学生 (2分)②由于小试管套在大试管中,小试管中的空气不易排除,且氢气从两试管空隙中逸出(2分)③将大试管慢慢往上移动(2分)
20. (1)AECDB (2分)
(2)连接好并检查气密性 ,(2分) A(2分)
(3)处理未反应完CO和新生成的CO2,(2分) 除CO2 (2分)
(4)搅拌、过滤 (2分)
(5)在HCl气氛中加热浓缩,冷却结晶 (2分)
21.(1)Fe3O4 ,H2 (4分)
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
|
3Fe3O4 +8Al=== 4Al2O3+ 9Fe (2分,无反应条件不给分)
22.(1)7 (2分)
(2)A-,HA (4分)
(3) 0.005 (2分)
(4) c(H2O)>c(Na+)>c(A-)>c(Cl-)>c(HA) >c(H+)>c(OH-)(2分)
23. 5 (2分) 10 (2分)
24.(1) 72 (2分) (2)C5H12(2分)
(3)CH3CH2CH2CH2CH3 , (CH3)2CHCH2CH3 ,C(CH3)4
(每写出一个给2分,共6分)
 |
(2) (2分)
|
25. 解 (1)CH4+2O2→CO2+2H2O
lmolCH4完全燃烧得到的CO2和H2O共80g,原混合气体中n(CH4)=0.600g/80g.mo1-1=0.0075mol (2分)
V(CH4)=0.0075molx22.4×lO3mL·mol‑1=168mL, (2分)
剩余气体的体积=840mL-3×168mL=336 mL (2分)
(2) V(CH4):V(O2)=168:(840—168)=168:672=1:4 (2分)
26. (1)过量,不足量(2分,各1分)
(2)1 (2分)
(3)0.255g、280mL,(1分) 52.9%(3分)
(4) 39 (4分)
n(Al)=52.9%×0.459g/27g.mol-1 = 0.009mol (1分)
∵Cl元素守恒 ∴n(NaCl)=n(HCl)=1×0.03=0.03mol (1分)
∵Al元素守恒 ∴n(NaAlO2)=n(Al)=0.009mol (1分)
∵Na元素守恒 ∴V(NaOH)=![]() =0.039L=39ml (1分)
=0.039L=39ml (1分)