高二化学下学期期末考试6
试题
第I卷 60分
考试时间120分钟 总分120分
一、 选择题(每小题只有一个正确答案,请将正确答案填在答题卡上,每小题3分,60分。)
1、可逆反应达到化学平衡的标志是:
A、反应停止了 B、正逆反应的速率均为零
C、正逆反应都还在进行 D、正逆反应的速率相等
2、决定化学反应速率的主要因素是:
A、反应物浓度 B、反应物的性质
C、使用催化剂 D、反应温度
![]() 3、甲、乙两个容器内都在进行A B的反应,甲中每分钟减少4molA,乙中每分钟减少2molA,则两容器中的反应速率:
3、甲、乙两个容器内都在进行A B的反应,甲中每分钟减少4molA,乙中每分钟减少2molA,则两容器中的反应速率:
A、甲快 B、乙快 C、相同 D、无法确定
4、恒温恒容下,对于已经达到平衡的可逆反应2NO2 ![]() N2O4
,增大NO2的浓度达到新平衡时,NO2的转化率:
N2O4
,增大NO2的浓度达到新平衡时,NO2的转化率:
A、先增大,后减小 B、增大 C、不变 D、减小
5、不能用勒夏特列原理解释的是
A、棕红色的NO2加压后颜色变深后变浅
B、由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C、加大压强更有利于合成氨
D、煅烧粉碎的硫铁矿利于SO2的生成
6、在密装闭容器中通入体积比为1:3的N2和H2,在一定条件下合成氨,达到平衡时N2的转化率为50%,则反应前与平衡时容器中分子数之比为:
A、3:4 B、4:3 C、1:4 D、2:1
7、下列物质的水溶液中,其pH小于7的是 ( )
A.NH4NO3 B.Na2CO3 C.Na2SO4 D.KNO3
8、在无色透明的强酸性溶液中,能大量共存的离子组是
A.NH![]() Na+ Cl- SO
Na+ Cl- SO![]() B.Cu2+ Mg2+ NO
B.Cu2+ Mg2+ NO![]() Cl-
Cl-
C.Al3+
Ag+ NO![]() Cl- D.Ba2+ K+ CO
Cl- D.Ba2+ K+ CO![]() Cl-
Cl-
9、下列离子方程式中,正确的是 ( )
A.醋酸与小苏打溶液反应 H++HCO![]() =CO2↑+H2O
=CO2↑+H2O
B.碳酸钠水解CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.铁与三氯化铁溶液反应 Fe+Fe3+=2Fe2+
D.铝与氢氧化钠溶液反应 2Al+2OH-+2H2O=2AlO-2+3H2↑
10、下列事实可证明氨水是弱碱的是
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1mol/L氨水可以使酚酞试液变红
D.0.1mol/L氯化铵溶液的pH约为5
11、10mL的0.1mol/L BaCl2 溶液恰好可使相同的体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
12、维生素A对人体特别是对人的视力有重要作用,其结构简式如下:
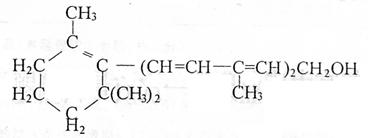
下列关于该化合物的说法中,正确的是
①维生素A是一种不饱和的一元醇 ②维生素A含有苯环结构 ③维生素A的分子中含有两种官能团 ④维生素A的一个分子中含有3个双键
A.②④ B.①③ C.③④D.全部正确
13、把三块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;b、c相连时,c不易腐蚀。则三种金属的活动性由强到弱的顺序为
A.a>b>c B.a>c>b C.c>b>a D.b>c>a
14、在一定条件下,向5L密闭容器中充入2 molA气体和1molB气体,发生可逆反应: 2A(g) +B(g) ![]() 2C(g) ,达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为
2C(g) ,达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为
A.67% B.50% C.25% D.5%
15、下列说法正确的是
A、碳水化合物就是碳的水合物
B、凡符合通式Cn(H2O)m的有机物就属于糖类
C、糖类物质在空气中完全燃烧,结果都能产生CO2和H2O
D、糖类物质就是有甜味的一类化合物
16、下列各组物质中最简式均为CH2O,且都能发生银镜反应的是
A、甲醛和乙醛 B、乙酸和乙酸乙酯
C、蔗糖和葡萄糖 D、甲醛和葡萄糖
17、只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液,这种试剂是
A、 NaOH溶液 B、Cu(OH)2悬浊液
C、石蕊试液 D、Na2CO3溶液
18、下列关于蛋白质的叙述中,不正确的是
A、蛋白质溶液中加入硫酸铵,蛋白质析出,若再加水还能溶解
B、蛋白质中的蛋白质分子能透过滤纸,但不能透过半透膜
C、重金属盐使蛋白质变性,所以吞食“钡餐”会引起中毒
D、浓硝酸溅在皮肤上,能使皮肤呈黄色,是由于蛋白质和浓硝酸发生颜色反应
19、现将一定量的O2、CH4、Na2O2置于一密闭容器中用电火花引燃,反应结束后,若容器内的压强为零(120℃),且残留物质溶于水且无气体生成,则O2、CH4、Na2O2三者的物质的量之比必须是
A.1:2:6 B.1:2:3 C.6:3:1 D.3:2:1
20、常用锌锰干电池在放最时的反应为:
Zn(固)+2MnO2(固)+2NH![]()
Zn2++Mn2O3+2NH3+H2O放电时,正极区发生反应的物质或微粒是
A.锌 B.只有二氧化锰
C.二氧化锰和铵根离子 D.锌离子和氨分子
第II卷(40分)
二、填空题(23分)
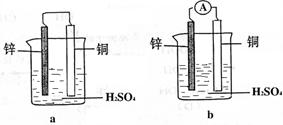
21、(6分)1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片,可观察到铜片上 ① (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(如图a所示)可观察到铜片上 ② (填“有”或“没有”)气泡产生。
2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连接(如图b所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。请用反应式来表示在导线中有电流通过的原因:锌片上的反应式: ③ ;铜片上的反应式: ④ 。
可见,图b是一个将化学能转化为电能的装置,人们把它叫做原电池。那么,一个正在工作着的原电池的形成条件是: ⑤ 。
22、(5分)如右图,向A中充入lmolX、lmoIY,向B中充入2molX、2molY,起始时,V(A)=V(B)=aL。在相同温度和有催化剂存在下,两容器中各自发生下述反应:
X+Y![]() 2Z+W+Q(X、Y、Z、W均为气体),达平衡时,V(A)=1.2aL。试回答:
2Z+W+Q(X、Y、Z、W均为气体),达平衡时,V(A)=1.2aL。试回答:
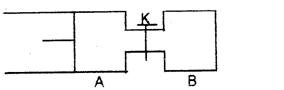
(1)A中X的转化率α(A)____①_。
(2)A、B中X的转化率关系:α(A)_②___α(B)(填“<”、“>”、“=”)。
(3)打开K,一段时间后又达到平衡,A的体积为_③__L(连通管中气体体积不计)。
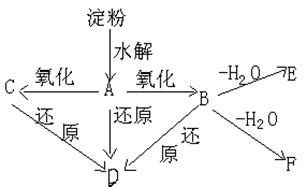
23、(6分)如图所示:淀粉水解可产生某有机物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。
已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之, (R)2-CHOH 最难。
![]()
![]() 请在下列空格中填写A、B、C、D、E、F的结构简式
请在下列空格中填写A、B、C、D、E、F的结构简式
A 、B 、C 、D 、E 、F 。
24、(6分)(1)在蔗糖中加入浓H2SO4,反应的化学方程式为 ,浓H2SO4的作用是 。
(2)在蔗糖溶液中加入稀H2SO4并加热,反应的化学方程式为 ,稀H2SO4的作用是 。
(3)向(2)溶液中加入新制的Cu(OH)2,加热未见砖红色沉淀,其原因是 。
(4)在(2)的产物中加入稀NaOH溶液后,取适量液体加到新制的Cu(OH)2悬浊液中水浴加热,反应的化学方程式是 。
三、计算题(17分)
25、(6分)充分燃烧1.4g某有机物A生成4.4gCO2和0.1mol H2O A的质量是同温同压下同体积氮气质量的2倍,求A的最简式和分子式。已知A的一氯取代物有两种,请写出A可能的结构简式。
26、将等物质的量两种氧化物溶于100mL硫酸中,然后逐滴加1.00mol/L的NaOH溶液。当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH的加入量逐渐增加。当NaOH的体积V2=650mL时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小,当V3≥750mL时,沉淀量不再改变。
①最初加入的50mLNaOH溶液的作用是什么?
②计算的用硫酸的物质的量浓度。
③试判断两种氧化物各是什么,并计算其物质的量。
![]() 下学期期末考试
下学期期末考试
高二化学参考答案
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | D | C | B | B | A | A | D | D |
| 题序 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | A | B | C | D | B | C | C | C |
 21、① 没有 ②
有
21、① 没有 ②
有
③ Zn-2e_=Zn2+ ④ 2H++2e_=H2↑
⑤ 两种活性不同的电极,电解质溶液,构成闭合电路.
22、① 10% ② > ③ 2.6aL
23、A、CH2(OH) CH (OH) CH (OH) CH (OH) CH (OH) CHO
B、CH2(OH) CH (OH) CH (OH) CH (OH) CH (OH) COOH
C、HOOC CH (OH) CH (OH) CH (OH) CH (OH) COOH
D、CH2(OH) CH (OH) CH (OH) CH (OH) CH (OH) CH2OH
E、CH2(OH) CH (OH) CH CH (OH) CH (OH) C=O
0
F、CH2(OH) CH CH (OH) CH (OH) CH (OH) C=O
0
24、① C12H22O11 =12C+ 1H2O 脱水剂
②C12H22O11+H2O=C6H12O12+ C6H12O12 催化剂
③存在硫酸,与新制氢氧化铜反应。
④C6H12O6+Cu(OH)2= C6H12O7+Cu2O+2H2O
25、C4H8
26、中和硫酸、33.25mol/L Al2O3 Fe2O3 各0.05mol