![]()
|
|
学科:化学 |
| 教学内容:高二化学期末测试题 |
【同步达纲练习】
一、选择题
1.下列物质容易导电的是( )
A.熔融的氯化钠 B.无水酒精
C.硫酸铜晶体 D.硝酸钾溶液
2.将锌片跟醋酸溶液反应,若在溶液中加入固体醋酸钠,则生成氢气的速率会( )
A.增大 B.减小
C.不变 D.先增大后减小
3.下列离子方程式中,正确的是( )
A.醋酸钠与盐酸反应:H++CH3COO-=CH3COOH
B.醋酸跟氨水反应 CH3COOH+OH-=CH3COO-+H2O
C.碳酸钙跟盐酸反应 CaCO3+2H+=Ca2++CO2↑+H2O
D.Cl2跟冷的NaOH溶液反应 2Cl2+2OH-=3Cl-+ClO-+H2O
4.氨水中存在下列的电离平衡:
NH3·H2O![]() NH+4+OH-
NH+4+OH-
要使平衡向逆反应方向移动,同时使OH-的浓度增大,应加入下列的( )
A.NaOH固体 B.NH4Cl固体 C.H2SO4 D.H2O
5.某固体化合物R不导电,但它熔化或溶于水中能完全电离.对此,下列关于R的说法正确的是( )
A.R为非电解质 B.R为强电解质
C.R为弱电解质 D.R为离子化合物
6.常温下,某溶液中c(OH-)=1×10-8mol/l,分别滴入石蕊、酚酞、甲基橙指示剂,溶液的颜色依次为( )
A.紫色 无色 黄色 B.蓝色 红色 黄色
C.红色 无色 橙色 D.紫色 红色 黄色
7.用0.01mol/LH2SO4滴定0.01mol/LNaOH,中和后加水至100ml,若滴定时终点判断有误差:①多加1滴H2SO4;②少加1滴H2SO4(设1滴为0.05ml)则①②中c(H+)之比值是( )
A.5×103 B.104 C.50 D.10
8.有一混合液可能含有NaOH,NaHCO3,Na2CO3中的一种或两种.现取等体积的两份溶液分别以酚酞和甲基橙作指示剂,用同样浓度的盐酸进行滴定,当达到滴定终点时,消耗盐酸的体积分别为V1ml和V2ml,若V2>2V1,则上述溶液中的溶质是( )
A.NaOH B.Na2CO3和NaHCO3
C.Na2CO3 D.Na2CO3和NaOH
9.欲除去含有1mol·L-1Mg(HCO3)2和2mol·L-1CaCl2的混合溶液中的Mg2+、Ca2+,选用下列一种试剂适量即可,该溶试剂是( )
A.NaHCO3 B.Na2CO3 C.NaOH D.Ca(OH)2
10.铝与Na2O2的混合物溶于足量水中,得到澄清溶液,同时产生气体3.5g,在所得溶液与7mol/LHCl 100mL作用过程中,先有白色沉淀生成,此后沉淀又恰好溶解,则Al与Na2O2的物质的量之比为( )
A.2∶1 B.1∶2 C.11∶2 D.2∶11
11.向一定体积一定浓度的Al2(SO4)3溶液中加入33ml某浓度的NaOH溶液,有![]() 的Al3+转化为Al(OH)3,则使其中2/3的Al3+转化为Al(OH)3,所加入NaOH溶液的体积可能是下列数据①18ml ②30ml ③66ml ④110ml中的( )
的Al3+转化为Al(OH)3,则使其中2/3的Al3+转化为Al(OH)3,所加入NaOH溶液的体积可能是下列数据①18ml ②30ml ③66ml ④110ml中的( )
A.只有③ B.只有③④
C.全部 D.缺少数据,无法计算
12.NaH是离子化合物,与水反应可生成碱和H2.现有NaH与铝粉混合物共mg,与足量水反应共收集到H2 ng,则原混合物中铝粉质量为( )
①(12n-m)g ②(24m-5n)g
③(36n-3m)g ④![]()
A.①② B.①③ C.③④ D.②④
二、填空题
1.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2-已知相同浓度时H2A的电离程度大于HA-的电离程度,设有下列四种溶液:
H++A2-已知相同浓度时H2A的电离程度大于HA-的电离程度,设有下列四种溶液:
A.0.01mol/L的H2A溶液
B.0.01mol/L的NaHA溶液
C.0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)c(H+)最大的是 ,最小的是 .
(2)c(H2A)最大的是 ,最小的是 .
(3)c(A2-)最大的是 ,最小的是 .
2.一定温度下,在冰醋酸的加水稀释过程中,溶液的导电能力Ⅰ随加入水的体积V变化的曲线如图所示,请回答:
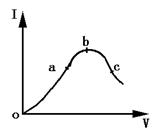
(1)“O”点导电能力为O的理由是 .
(2)a,b,c三点处,溶液中c(H+)由大到小的顺序为 .
(3)a,b,c三点处,PH由大到小的顺序为 .
(4)若使c点溶液中c(Ac-)增大,溶液中c(H+)减小,可采取的措施是:(1) , (2) ,(3) .
3.在硫化氢的饱和溶液中存在的电离平衡是:
H2S+H2O![]()
![]() +HS-,HS-+H2O
+HS-,HS-+H2O![]()
![]() +S2-
+S2-
(1)其中[HS-] [S2-],[HS-] [H+],[H+] [S2-](大于、小于或等于)
(2)若加NaOH固体,[S2-]将 ,S2-的物质的量将 溶液的PH值将 .
(3)若加入无水CuSO4,[S2-]将 ,电离平衡向 移动,溶液的PH值将 .
4.取相同体积(0.025L)的两份0.01mol/LNaOH溶液,把其中一份放在空气中一段时间后,溶液的PH值 (填增大、减小或不变),其原因是 .用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为VA,另一份消耗硫酸溶液的体积为VB,则:(1)以甲基橙为指示剂时,VA与VB的关系是 ,(2)以酚酞为指示剂时,VA与VB的关系是 .
5.有A、B两瓶氨水,浓度分别为1mol/L和0.1mol/L,则A、B两瓶氨水中[OH-]的比
10.(用大于、小于、等于填写).其理由是 .
6.在某化工生产中要用到一种无色、可溶于水的晶体——铝铵矾.该晶体是一种复盐,其主要成分为十二水合硫酸铝铵.向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化.已知NH+4与AlO-2在水溶液中不能大量共存,会发生如下反应:![]() +
+![]() +H2O=Al(OH)3↓+NH3
+H2O=Al(OH)3↓+NH3![]()
试回答:
(1)在硫酸铝铵水溶液中滴入石蕊试液,观察到的现象是 ,其原因是 .
(2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀,②有刺激性气味的气体逸出;
③白色沉淀量逐渐增多;④白色沉淀完全消失;
⑤白色沉淀量逐渐减少.请回答出各种现象由先到后的顺序 .
(3)写出滴入NaOH溶液的过程中,有关反应的离子方程式:① ,② ,③ .
7.现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
(1)甲溶液为 溶液,其物质的量浓度为 .mol·L-1;乙溶液为 溶液,其物质的量浓度是 mol·L-1
(2)写出实验③的有关离子方程式 .
8.已知在水溶液中,![]() 离子呈橙红色,
离子呈橙红色,![]() 离子呈黄色,Cr3+离子呈绿色,当K2Cr2O7溶于水时,有下列平衡:
离子呈黄色,Cr3+离子呈绿色,当K2Cr2O7溶于水时,有下列平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+
+2H+
(1)若往K2Cr2O7溶液里滴加H2SO4溶液时,观察到的现象是 .
(2)再往(1)中所得溶液里通入H2S气体,观察到溶液呈绿色并有黄色沉淀生成,离子方程式为 .
(3)另取一部分K2Cr2O7溶液,滴加NaOH溶液,其现象是 ,此时原溶液中离子浓度下降的是 .
9.在CH3COOH的水溶液中加入少量固体CH3COONa后,溶液的PH值变 ;其原因是(用文字和相应的离子方程式简要叙述) .在该混合液中滴入少量稀H2SO4时,其PH值基本不变,原因是 .
10.纯净的锌与稀硫酸反应制氢气,反应速度较慢,为了加快反应速度,又不影响氢气的产量,可向稀硫酸中加入一种盐,这种盐是 ,原因是 .
11.以Cl-、![]() 、
、![]() 、Cu2+、H+五种离子恰当地组成电解质,按下列要求进行电解:(1)以石墨为电极,使电解质质量减少,水量不减少,选用的电解质是
;
、Cu2+、H+五种离子恰当地组成电解质,按下列要求进行电解:(1)以石墨为电极,使电解质质量减少,水量不减少,选用的电解质是
;
(2)以石墨为电极,使电解质质量不变,水量减少,可选用的电解质是 ;
(3)以石墨为阳极,铁为阴极,使电解质和水量都减少,选用的电解质是 .
12.将石墨电极A和B,浸入盛有200g10%的硝酸银溶液的烧杯中,将直流电源P、Q两极分别与A、B相连,通电一段时间后,A极因附着析出物质,而增至2.16g,则B极逸出气体质量为 g,电源的P极是 极,A极发生 反应,电解反应式为 ,此时硝酸银溶液的质量百分比浓度为 .
13.某无色溶液与金属铝反应放出H2,试推断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、![]() 、
、![]() 、
、![]() 、OH-、
、OH-、![]() ,何者能存在于溶液中?
,何者能存在于溶液中?
(1)当有Al3+存在时,可能存在:
(2)当有![]() 存在时,可能存在:
存在时,可能存在:
14.某科研小组用高岭土(主要成分是Al2O3、SiO2、2H2O并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物),其实验步骤如下:将土样和纯碱混合均匀,加热熔融,冷却后用水浸取熔块,过滤,弃去滤渣.滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即为净水剂.
(1)写出熔融时主要成分与纯碱反应的化学方程式:
(2)最后的沉淀物是 生成它的离子方程式是 ;
(3)实验室常用坩埚有石英坩埚、瓷坩埚、氧化铝坩埚和铁坩埚,本实验在熔融土样时应选用 坩埚.
三、简答题
1.有两瓶PH=2的酸溶液,一瓶是强酸,一瓶是弱酸.现只有石蕊试液,酚酞试液,PH试纸和蒸馏水,而没有其它试剂.简述如何用最简便的实验方法来判断哪瓶是强酸.
2.向FeSO4溶液中滴加饱和H2S溶液,有什么现象?向FeSO4溶液中加Na2S溶液又会产生什么现象?试解释产生这种现象的原因.
四、实验题
1.(1)图Ⅰ表示10ml量筒中液面的位置,A与B,B与C刻度相差1ml,如果刻度A为6,量筒中液体的体积是 ml.
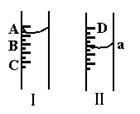
(2)图Ⅱ表示50ml滴定管中液面的位置,如果液面处的读数为a,则滴定管中液体的体积(填代号)
A.是aml B.是(50-a)ml
C.一定大于aml D.一定大于(50-a)ml
(3)若图Ⅰ表示50ml滴定管中液面位置,A与C刻度间相差1ml,如果刻度A为6,则液面读数为 ml.
2.某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品ag,称取时使用的仪器名称为 .
(2)将样品溶解于足量的稀盐酸中,过滤,滤液中主要含有 ,滤渣中含有 ;在溶解、过滤时使用的仪器有 .
(3)往滤液中加入过量NaOH溶液,过滤.写出该步操作中有关的离子方程式 , , .
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称重质量为bg.有关的化学方程式为 , .
(5)该样品中铝的质量分数的表达式为 .
(6)若第(3)步中加入NaOH的量不足时,会使测定的结果(偏高、偏低、不影响) .
若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果(偏高、偏低、不影响) .
若第(4)步中对沉淀的灼烧不充分时,会使测定的结果(偏高、偏低、不影响) .
五、计算题
工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如下:

| Al2O3 | Fe2O3 | Na2O | |
| 铝土矿 | 55% | 16% | 0% |
| 赤泥 | 15% | 48% | 8% |
经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见上表,(以氧化物表示,Na2O由NaOH折算),且已知铝土矿中的Fe2O3全部转入赤泥.
(1)生产中每消耗1t铝土矿将产生 t赤泥.
(2)试计算每炼出1t铝,理论上需要多少吨铝工矿?应补充多少吨NaOH?
2.称取某金属氧化物(MO)14.94g,将它溶于稀H2SO4中,然后再加蒸馏水稀释至250mL.取这种溶液50mL,加入适量其他物质,用铂做电极进行电解得到2.348g这种纯金属.试回答:
(1)M是下列哪一种金属:Mg、Ni、Cu、Ca、Pb
(2)析出2.348g金属时,消耗多少摩电子?多少库仑电量?(每摩电子电量为96500库仑)
(3)最初溶液中,金属离子的摩尔浓度是多少?
3.将MgCl2和AlCl3的混合物36.2g溶于水配成500mL溶液,从中取出50mL加入过量的NaOH溶液,将生成的沉淀过滤、洗涤、干燥后称重为0.58g.
求(1)混合物中AlCl3的质量分数?
(2)溶液中MgCl2和AlCl3的物质的量浓度是多少?
4.我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看做Ca2+,并将其质量折算成CaO的质量,通常把1L水中含有10mgCaO称为1度.水中的Ca2+和Mg2+可用一定浓度的y溶液进行滴定,y跟Ca2+和Mg2+都以等物质的量完全反应.
(1)现取某地区的地下水样品25.0mL,用0.0100mol/Lx溶液滴定,完全反应时消耗y溶液15.0mL.试计算该地下水的硬度,并判断是否符合饮用水标准.
(2)如果每次分析时取的水样都是25.0mL为了便于计算,要求每消耗0.50mLy溶液即相当水的硬度为1度,则y溶液的物质的量浓度应为多少?

参考答案:
【同步达纲练习】
一、1.AD 2.B 3.AC 4.A 5.BD 6.A 7.B 8.B 9.C 10.B 11.C 12.D
二、1.(1)A;D (2)C;D (3)D;A 2.(1)HAc未电离,无离子存在
(2)c<a<b (3)b<a<c (4)①加NaOH固体 ②加Na2CO3固体 ③加入Mg,Zn等金属 3.(1)大小 小于 大于 (2)增大 增大 增大 (3)减小 正向 减小
4.减小,因吸收CO2生成Na2CO3使NaOH减少.(1)VA=VB (2)VA<VB
5.<,由题可知A溶液的浓度为B溶液浓度的10倍,但氨水为弱电解质,浓度越小,电离度越大,所以B溶液中[OH-]不是A溶液中[OH-]的![]() ,而要较
,而要较![]() 大些,故应填“<”.
大些,故应填“<”.
6.(1)变红;![]() 和Al3+水解显酸性
和Al3+水解显酸性
(2)①→③→②→⑤→④(3)①Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
②![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
③Al(OH)3+OH-![]()
![]() +2H2O
+2H2O
7.(1)AlCl30.5mol·L-1;NaOH 0.5mol·L-1
(2)Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
Al(OH)3+OH-![]()
![]() +2H2O
+2H2O
8.(1)呈橙红色; (2)![]() +3H2S+8H+=2Cr3++S↓+7H2O; (3)呈黄色;Cr2O2-7,H+
+3H2S+8H+=2Cr3++S↓+7H2O; (3)呈黄色;Cr2O2-7,H+
9.(1)变大,CH3COONa完全电离出的![]() 使CH3COOH的电离平衡向左移动,使电离产生的H+浓度变小,PH值变大.
使CH3COOH的电离平衡向左移动,使电离产生的H+浓度变小,PH值变大.
(2)H2SO4完全电离的H+与溶液中较多的CH3COO-结合成CH3COOH分子,使溶液中的[H+]变化不大.
10.CuSO4.反应生成的Cu沉积在Zn表面上,在稀H2SO4中形成Cu-Zn原电池,从而加快了Zn的腐蚀速度,即加快了生成氢气的速度.
11.(1)HCl,CuCl2 (2)Na2SO4,H2SO4;NaHSO4 (3)NaCl,CuSO4
12.0.016g,负极,还原,Ag++e=Ag,8.4%
13.(1)H+、Mg2+、![]() (2)OH-、Ba2+、
(2)OH-、Ba2+、![]()
14.(1)SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(2)H2SiO3;4H++SiO2-3+H2O![]() H4SiO4↓
H4SiO4↓![]() H2SiO3+H2O (3)铁坩锅
H2SiO3+H2O (3)铁坩锅
三、1.各取等体积酸溶液于试管中,加蒸馏水稀释相同倍数(如10倍),然后用PH试纸分别测其PH,PH变化大的那瓶是弱酸,PH变化小的那瓶是强酸.
2.向FeSO4溶液中滴加饱和H2S溶液,没有明显现象,而向此溶液中滴加Na2S溶液,则会有黑色沉淀生成.其原因是:H2S为弱酸溶液,在溶液中存在如下平衡:H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-.因此硫离子浓度很小,而溶液中氢离子浓度较大.FeS是难溶于水但可溶于酸的物质,因此加入H2S溶液不会产生沉淀;而加入Na2S溶液情况则大不相同.由于Na2S是强电解质,在溶液中Na2S
H++S2-.因此硫离子浓度很小,而溶液中氢离子浓度较大.FeS是难溶于水但可溶于酸的物质,因此加入H2S溶液不会产生沉淀;而加入Na2S溶液情况则大不相同.由于Na2S是强电解质,在溶液中Na2S![]() 2Na++S2-,从而使[S2-]增大,同时溶液中[H+]没有明显变化,因此在加入Na2S溶液后,会产生FeS的黑色沉淀.
2Na++S2-,从而使[S2-]增大,同时溶液中[H+]没有明显变化,因此在加入Na2S溶液后,会产生FeS的黑色沉淀.
四、1.(1)5.8 (2)D (3)6.10 2.(1)天平;(2)AlCl3、MgCl2;Cu、Si;烧杯、玻璃棒、漏斗、带铁圈的铁架台(或漏斗架)
(3)Mg2++2OH-![]() Mg(OH)2↓ Al3++4OH-
Mg(OH)2↓ Al3++4OH-![]()
![]() +2H2O
+2H2O
(4)NaAlO2+CO2+2H2O![]() Al(OH)3↓+NaHCO3
Al(OH)3↓+NaHCO3
2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
(5)![]() ×100%
×100%
设原合金中含铝xg,关系式:
2Al———Al2O3
![]() =
=![]() x=
x=![]() b
b
所以合金中铝的质量分数为![]() ×100%
×100%
(6)偏低 偏高 偏高 加入NaOH的量不足时,有一部分Al(OH)3没有转化为AlO-2而损失,导致b值偏小,从而使测定结果偏低.
若不用蒸馏水洗涤沉淀,沉淀上会附有杂质,导致b值偏大,使测定结果偏高.若对Al(OH)3灼烧不充分时,有一部分Al(OH)3混入Al2O3中,导致b值偏大,使测定结果偏高.
五、1.(1)![]() (2)3.78t 0.13t 2.(1)Ni (2)7720库仑 (3)浓度:0.8mol/L 3.(1)73.76% (2)MgCl2 0.2mol/L;AlCl30.4mol/L 4.(1)33.6度;不符合饮用标准 (2)8.92×10-3(mol/L)
(2)3.78t 0.13t 2.(1)Ni (2)7720库仑 (3)浓度:0.8mol/L 3.(1)73.76% (2)MgCl2 0.2mol/L;AlCl30.4mol/L 4.(1)33.6度;不符合饮用标准 (2)8.92×10-3(mol/L)
