高二化学期末试卷
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Mg—24
S—32 Cl—35.5 K—39 Cu—64 Al—27 N—14 Na—23
一、选择题(每小题只有1个选项符合题意)
1.在VA族元素中下列叙述正确的是( )
A.最外层均有5个电子
B.在气态氢化物中都是显+3价
C.最高价氧化物对应水化物为H3RO4或HRO3,显酸性
D.非金属性随核电荷数的递增而增强
2.某元素的原子序数为7,对它的认识有错误的是( )
A.它处于元素周期表中第二周期VA族
B.它的最高正价为+5,负价为 -3
C.它的最高价氧化物对应水化物是一种强酸
D.它的非金属性比磷弱比氧强
3.下列叙述能说明R元素是氮族元素的是( )
A.R元素的最高价是+5价
B.R元素有气态氢化物RH3
C.R的氧化物可形成化学式为HRO3的含氧酸
D.其含氧酸是一元强酸
4.起固定氮作用的化学反应是( )
A.N2与H2在一定条件下反应生成NH3
B.NO遇O2转化为NO2
C.硝酸工厂用NH3氧化制NO
D.由NH3制碳酸氢铵和硫酸铵
5.下列气体水溶性最强的是( )
A.NO2 B.NH3 C.HCl D.SO2
6.Murad等三位教授最早提出NO分子在人体内有独特功能而获1998年诺贝尔奖,关于NO的下列叙述,不正确的是( )
A.NO可以是某些低价N物质氧化的产物
B.NO不是亚硝酸酐
C.NO是红棕色气体
D.NO可以是某些高价N物质还原的产物
7.判断市面上的金首饰是否含有铜,可以取样品与某试剂进行反应,根据现象即可判断,该试剂是( )
A.浓盐酸 B.硝酸 C.王水 D.稀硫酸
8.一定条件下反应N2(g)+3H2(g)![]() 2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
9.在2A+B![]() 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.v(A) = 0.5mol·L-1·S-1 B.v(B) = 0.3 mol·L-1·S-1
C.v (C) = 0.8mol·L-1·S-1 D.v (D)= 1 mol·L-1·S-1
10.已知450℃时,反应H2(g)+I2(g)![]() 2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)![]() H2(g)+I2(g)的化学平衡常数为( )
H2(g)+I2(g)的化学平衡常数为( )
A.50 B.0.02 C.100 D.无法确定
11.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是( )
A.2NO+O2![]() 2NO2
B.N2O4
2NO2
B.N2O4![]() 2NO2
2NO2
C.Br2(g)+H2![]() 2HBr
D.6NO+4NH3
2HBr
D.6NO+4NH3![]() 5N2+3H2O
5N2+3H2O
12.在2L的密闭容器中,发生3A(g)+B(g)![]() 2C(g)的反应,若最初加入A和B都是4mol,10s后,测得v(A)=0.12mol·(L·S)-1,则此时容器中B的物质的量是( )
2C(g)的反应,若最初加入A和B都是4mol,10s后,测得v(A)=0.12mol·(L·S)-1,则此时容器中B的物质的量是( )
A.1.6mol B.2.8mol
C.3.2mol D.3.6mol
13.下列叙述正确的是( )
A.强电解质水溶液的导电性不一定比弱电解质水溶液的强
B.氯气的水溶液能导电,所以氯气属于电解质
C.硫酸铜晶体含有一定量的水,所以硫酸铜晶体能导电
D.在一定条件下,经过足够长的时间,电解质的电离一定能达到电离平衡
14.下列事实中能证明氯化氢是共价化合物的是( )
A.氯化氢极易溶于水
B.液态氯化氢不导电
C.氯化氢不易分解
D.氯化氢溶液可以电离
15.在KHSO4的极稀溶液和熔融状态下都存在的离子是( )
A.H+ B.HSO4-
C.SO42- D.K+
16.相同温度下,下列物质中导电能力最强的是( )
A.1000mL 0.1mol/L的KOH溶液
B.2L 0.1mol/L的CH3COOH溶液
C.100 mL 0.1mol/L的HF溶液
D.100 mL 0.1mol/L的K2SO4溶液
17.甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L甲酸溶液的[H+]约为1×10-2mol/L
B.甲酸能与水以任何比例互溶
C.10mL 1mol/L甲酸恰好与10ml 1mol/L NaOH溶液完全反应。
D.在相同条件下,甲酸溶液的导电性比强酸溶液的弱。
18.在同一温度下,若弱电解质溶液a,强电解质溶液b,金属导体c三者的导电能力相同,当升高温度后,它们的导电能力将是( )
A.a>b>c
B.a=b=c
C.c>a>b
D.b>c>a
19.下列关于电离度的说法正确的是( )
A.电离度的大小决定溶液导电能力的强弱。
B.等温、等浓度时,电离度可表示弱酸的相对强弱。
C.电解质的电离度随温度的升高而减小。
D.电离度大的溶液内,离子浓度也必然大。
20.相同温度下,两种稀氨水A和B,浓度分别为0.2mol/L和0.1mol/L,则A和B的[OH -]浓度之比为( )
A.大于2 B.小于2
C.等于2 D.不能肯定
21.铝的硬度比镁的大,熔点、沸点比镁的高,主要是因为铝比镁( )
A.金属离子与自由电子的相互作用强
B.核电荷数多
C.密度大
D.金属性强
22.用于飞机制造业的重要材料是( )
A.Mg—Al合金 B.Cu—Sn合金
C.Al—Si合金 D.不锈钢
23.在常温下,将铝分别投入下列溶液中,溶液质量会减少的是( )
A.稀硫酸
B.NaOH溶液
C.CuSO4溶液
D.食盐水
24.镁比铝的金属性强,以下说法中不能说明这一点的是( )
A.氢氧化铁是中强碱而氢氧化铝具有两性
B.铝在冷的浓硫酸中钝化而镁不钝化
C.Mg、Al与等物质的量浓度的盐酸反应,镁较剧烈
D.镁能与沸水反应而铝不能
25.常温下铝制容器能盛放的物质的组合是①浓硝酸 ②稀硝酸 ③浓硫酸 ④稀硫酸 ⑤浓盐酸 ⑥烧碱 ⑦水 ( )
A.①③⑦
B.①③⑤⑥
C.①②④⑥
D.全能
二、选择题(每小题有1~2个选项符合题意)
26.下列反应,硝酸既表现了酸性,又表现了氧化性的是( )
A. Fe2O3+HNO3 B.FeO+HNO3
C.石蕊试液与HNO3相混合 D.SO2+HNO3
27.工业制镁粉时,需将镁粉蒸气进行冷却,冷却最好在下列哪些物质中进行( )
A.空气 B.氮气
C.二氧化碳 D.氢气
28.铝热剂中铝的作用是( )
A.催化剂 B.氧化剂
C.还原剂 D.填充剂
29.下列离子不能大量共存于同一溶液中的是( )
A.NH4+、NO3-、Fe2+、H+
B.SO32-、NO3-、K+、H+
C.Cl-、Cu2+、SO42-、NO3-
D.NO3-、Na+、Ba2+、Ag+
30.只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是( )
A.AgNO3 B.NaOH
C.BaCl2 D.Ba(OH)2
31.用蒸馏水逐步稀释0.1mol/L的稀氨水,若温度不变,在稀释过程中下列数据始终保持增大趋势的是( )
A.[OH-] B.[NH4+]
C.[NH3·H2O] D.[NH4+]/[NH3·H2O]
32.将盛满NO2、O2的试管倒扣在水槽中,让其充分反应,结果剩余1/10体积气体。原混合气体中NO2和O2的体积比可能是( )
A.18 : 7 B.3 : 2
C.9 : 1 D.43 : 7
33.下列各分子中所有原子都满足最外层为8电子结构的是( )
A.BeCl2 B.PCl3 C.PCl5 D.N2
34.有氨和氧的混合气44.8L(标准状况下),在密闭容器里的一定条件下充分反应后再经水处理,剩下气体在常温下刚好能与12.4g白磷完全反应。则氨和氧混合时的体积比是( )
A.1 : 2 B.2 : 3 C.1 : 3 D.4 : 5
35.某固体化合物A不导电,但熔化或溶于水能完全电离。下列关于物质A的说法中,正确的是( )
A.为非电解质
B.A是强电解质
C.A是离子晶体
D.A是弱电解质
36.用下列金属与足量酸反应时,要得到相同体积的氢气,所需金属质量最少的是( )
A.Mg B.Fe
C.Zn D.Al
37.将同质量的铝,分别投入每组的两种足量的溶液中,放出氢气的量相等的是( )
A.稀H2SO4 NaOH
B.盐酸 浓硝酸
C.氢氧化钠 稀HNO3
D.盐酸 浓硫酸
38.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH(固) B.H2O
C.NH4Cl(固) D.CH3COONa(固)
39.将镁条在空气中点燃后,其产物用水溶解,过滤后所得固体物质是( )
A.只有MgO
B.只有Mg(OH)2
C.只有Mg3N2
D.MgO和Mg(OH)2
40.下列各组物质反应后,溶液的导电性比反应前明显增强的是( )
A.向亚硫酸钠溶液中加液态溴
B.向硝酸银溶液中通入少量氯化氢气体
C.向氢氧化钠溶液中通入少量氯气
D.向硫化氢饱和溶液中通入少量氯气
三、填空题
41.地球外层空间存在微量臭氧(O3)分子和氧原子,该臭氧层能吸收阻挡太阳强烈有害的紫外线辐射,可是人为的大气污染物会破坏臭氧层,如超音速飞机排放物中的氮氧化物(NO和NO2),它们与O3、O发生如下反应:
O3+NO=NO2+O2 ; NO2+O=NO+O2
这两个反应反复循环,其总反应式为 ,由此可见氮氧化物在破坏臭氧层过程中起了 的作用。
42.工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用等体积水稀释。试简答:
(1)用稀硝酸而不用浓硝酸的原因:
(2)写出Cu与浓、稀硝酸两个反应的方程式:
;
。
(3)从经济效益和环保角度考虑、设计制取硝酸铜最适宜方法,用化学方程式表示为:
。
43.(1)氮族元素的核外电子排布,次外层为8个电子的元素为 ,主要的化合价表现为 价和 价。
(2)现有六种金属:金、银、铜、铁、铝、铂,依次阅读①至⑥的描述,确定a至f分别代表哪一种金属,把答案填在下表内。
① c和d都能溶于稀硫酸,并且放出氢气;
② c放入氢氧化钠溶液中,溶解并且放出氢气;
③ a和b只溶于王水;
④ a可以用作氨催化氧化的催化剂;
⑤ e和f不能与盐酸反应,但能溶于硝酸;
⑥ 将e放入含f离子的水溶液中,e溶解而析出f。
| 代号 | a | b | c | d | e | f |
| 元素符号 |
44.在密闭容器中的可逆反应CO(g)+NO2(g)![]() CO2(g)+NO(g)+Q达到平衡后:
CO2(g)+NO(g)+Q达到平衡后:
(1)扩大容器体积,平衡 ,C(NO2)将 ,反应混合物的颜色 。
(2)升高温度平衡 ,体系的压强 。
(3)加入催化剂,NO的物质的量 ,原因是 。
45.根据NH2·H2O的电离方程式 。结合变化量填下表。
|
 | H2O | NH4Cl (s) | NaOH (s) | HCl (1) | ||||||||||||||||||
| (1)Kb | ||||||||||||||||||||||
| (2)n (OH-) | ||||||||||||||||||||||
| (3)c (OH-) | ||||||||||||||||||||||
| (4)平衡移动方向 |
46.当滴有少量CH3COOH的CH3COONH4的混合物溶于水后,存在着的电离或离子反应的平衡有:
(1) ,
(2) ,
(3) 。
由于 平衡的存在,抑制了 平衡的移动。
47.某可溶性盐的化学式XmYn(m≠n),将一定量的该盐溶于适量的水中。
(1)若测得溶液的pH为3,则该盐与水反应的离子方程式可能为
。
(2)若该盐水溶液的pH为11,则其与水反应的离子方程式可能为
。
 四、实验题
四、实验题
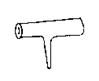
48.实验室里常见到右图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。该仪器可进行多项实验。当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点。
(1)用此仪器不能反复进行的实验是 (填序号)
A.NH4Cl固体受热分解
B.KMnO4晶体受热分解
C.白磷和红磷一定温度下互相转变
D.无水CuSO4和胆矾的互变实验
(2)当玻璃管内装有NO2和N2O4的混合气体时,亦可反复进行反应条件对化学平衡影响的实验,该实验的操作过程和实验现象是 。
(3)如果玻璃管内装有大量红色溶液,加热时溶液颜色变浅,冷却时恢复红色,该溶液可能是 ,如果玻璃管内封有少量无色溶液,加热溶液时,溶液变红,冷却后恢复无色。此溶液可能是 。
五、推断题
49.现有A、B、C三种气体,A在一定条件下能与O2反应生成B,B不溶于水,但却能与O2反应生成C,A和C都能溶于水,前者呈碱性,后者呈酸性,两者水溶液相混合得到了D的溶液,请填答A、B、C、D的化学式:
A ,B ,C ,D 。
六、计算题
50.在托盘天平的两盘内各放一只盛有50mL 4mol/L盐酸的烧杯,把天平调节至平衡,然后在一只烧杯中放入6g铝,为了不破坏天平的最终平衡,在另一只烧杯里应放入多少克铁?
51.将13.1g镁、铝、铁的混合物与足量的氢氧化钠溶液共热,标准状况下产生3.36L氢气,再将剩余溶液过滤后的残渣跟足量稀H2SO4反应,待完全反应后,标准状况下又产生6.72L氢气。求混合物中各组分的质量分数。
 |
『答案』
一、选择题
1.A 2.D 3.B 4.A 5.B 6.C 7.B
8.C 9.B 10.B 11.C 12.D 13.A 14.B
15.D 16.D 17.A 18.A 19.B 20.B 21.A
22.A 23.C 24.B 25.A
二、选择题
26.BC 27.D 28.C 29.AB 30.D 31.D 32.AD
33.B 34.C 35.BC 36.D 37.A 38.BD 39.D
40.AD
三、填空题
41.O3+O=2O2 ; 催化剂
42.(1)生成等物质的量的硝酸铜,用稀硝酸时,消耗原料较少,且产生污染物的量也较少。
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
![]() 3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
(3)2Cu+O2 2CuO;
CuO+2HNO3=Cu(NO3)+H2O
43.(1)磷;+3;+5
(2)Pt、Au、Al、Fe、Cu、Ag
44.
(1)不移动;减少;变浅
(2)左移;不变
(3)不变;催化剂不影响平衡
45.NH3·H2O![]() NH4++OH-;
NH4++OH-;
(1)不变,不变,不变,不变;
(2)增加,减少,增加,减少;
(3)减少,减少,增加,减少;
(4)正向,逆向,逆向,正向。
46.(1)CH3COOH![]() CH3COO-+H+,
CH3COO-+H+,
(2)NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
(3)CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
(1) ;(3)
47.(1)Xn++nH2O![]() X(OH)n+nH+
X(OH)n+nH+
(2)Ym-+H2O![]() HY(m-1)-+OH-
HY(m-1)-+OH-
四、实验题
48.(1)B;
(2)将该装置浸入冰水中,颜色变浅,再取出,擦干水,放在酒精灯上烘烤,颜色变深。
(3)稀氨水和酚酞的混合溶液;被SO2漂白后的品红溶液
五、推断题
49.A.NH3 ; B.NO ; C.NO2 ; D.NH4NO3
六、计算题
50.6g
51.Al:20.6%,Mg:36.6%,Fe:42.8%