高二化学期末综合练习题
一、选择题
1.下列物质容易导电的是( )
A.熔融的氯化钠 B.无水酒精 C.硫酸铜晶体 D.硝酸钾溶液
2.将锌片跟醋酸溶液反应,若在溶液中加入固体醋酸钠,则生成氢气的速率会( )
A.增大 B.减小 C.不变 D.先增大后减小
3.氨水中存在下列的电离平衡: NH3·H2O![]() NH+4+OH-要使平衡向逆反应方向移动,同时使OH-的浓度增大,应加入下列的( )
NH+4+OH-要使平衡向逆反应方向移动,同时使OH-的浓度增大,应加入下列的( )
A.NaOH固体 B.NH4Cl固体 C.H2SO4 D.H2O
4.常温下,某溶液中c(OH-)=1×10-8mol/l,分别滴入石蕊、酚酞、甲基橙指示剂,溶液的颜色依次为( )
A.紫色 无色 黄色 B.蓝色 红色 黄色 C.红色 无色 橙色 D.紫色 红色 黄色
5.有一混合液可能含有NaOH,NaHCO3,Na2CO3中的一种或两种.现取等体积的两份溶液分别以酚酞和甲基橙作指示剂,用同样浓度的盐酸进行滴定,当达到滴定终点时,消耗盐酸的体积分别为V1ml和V2ml,若V2>2V1,则上述溶液中的溶质是( )
A.NaOH B.Na2CO3和NaHCO3 C.Na2CO3 D.Na2CO3和NaOH
6.欲除去含有1mol·L-1Mg(HCO3)2和2mol·L-1CaCl2的混合溶液中的Mg2+、Ca2+,选用下列一种试剂适量即可,该试剂是( )
A.NaHCO3 B.Na2CO3 C.NaOH D.Ca(OH)2
7.铝与Na2O2的混合物溶于足量水中,得到澄清溶液,同时产生气体3.5g,在所得溶液与7mol/LHCl 100mL作用过程中,先有白色沉淀生成,此后沉淀又恰好溶解,则Al与Na2O2的物质的量之比为( )
A.2∶1 B.1∶2 C.11∶2 D.2∶11
8.向一定体积一定浓度的Al2(SO4)3溶液中加入33ml某浓度的NaOH溶液,有1/3的Al3+转化为Al(OH)3,则使其中2/3的Al3+转化为Al(OH)3,所加入NaOH溶液的体积可能是下列数据①18ml ②30ml ③66ml ④110ml中的( )
A.只有③ B.只有③④ C.全部 D.缺少数据,无法计算
9.NaH是离子化合物,与水反应可生成碱和H2.现有NaH与铝粉混合物共mg,与足量水反应共收集到H2 ng,则原混合物中铝粉质量为( )
①(12n-m)g ②(24m-5n)g ③(36n-3m)g ④![]()
A.①② B.①③ C.③④ D.②④
10.在FeCl3和AlCl3的混合液中,先加入过量的NaI溶液,再加入足量的Na2S溶液,则所得的沉淀是( )
A、Al2S3 和 I2 B、Fe(OH)2 和 Al(OH)3 C、Fe2S3 和I2 D、 FeS 、 S、 Al(OH)3
11.下列实验能达到测量要求的是( )
A. 用托盘天平称取35.20g NaCl B. 用10ml量筒量取8.50ml盐酸
C. 用25ml滴定管量取15.80ml溶液 D. 用PH试纸测得溶液PH值为4.2
12.在与Al反应放出H2的溶液中,可能大量共存的离子组是( )
A、Al3+ 、Mg2+ 、SO42- 、 Cl- B、K+ 、 Ba2+ 、 Cl- 、 NO3-
C、S2- 、 NO3- 、 NH4+ 、Na+ D、Na+ 、AlO2- 、 SO42- 、Mg2+
13.制取下列物质的方案能够达到目的是( )
A、用食盐、二氧化锰和稀H2SO4共热制Cl2 B、用碳酸钠与稀H2SO4反应制CO2
C、用生锈的废钢铁与稀H2SO4反应制绿矾 D、在FeCl3溶液中通入H2S制备Fe2S3
14.把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,产生白色沉淀,在上述一系列变化过程中,氧化剂是( )
A、SO2 B、SO42- C、Fe3+ D、HNO3
15.将7.8 gMg Al合金溶于120ml 4mol/L H2SO4中,当合金完全溶解后,再加入120 ml 8mol/L的NaOH溶液,得到沉淀的质量为21.4g,则加入H2SO4时产生的氢气的物质的量为( )
A、0.4 mol B、0.6mol C、0.8mol D、1.0mol
16.常温下某溶液中由水电离产生的[H+]=1×10-5mol/L,则下列叙述正确的是( )
A.PH值为5 B.一定是酸溶液
C.可能是强酸的酸式盐溶液 D.PH值可能为9
17、把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g) ![]() H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是
H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是
A、HI的生成速率等于其分解速率 B、HI的生成速率小于其分解速率
C、HI的生成速率大于起分解速率D、无法判断HI的生成速率和分解速率的相对大小
18、在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,则溶液颜色
A、变蓝色 B、变深 C、变浅 D、不变
19、下列液体pH>7的是
A、人体血液 B、蔗糖溶液 C、橙汁 D、胃液
20、镁和铝都是较活泼金属,下列叙述不正确的是
①镁易溶于冷水,而铝难溶于冷水 ②镁溶于碱液,而铝难溶于碱液 ③常温下镁难溶于浓硫酸,而铝易溶于浓硫酸
A、① B、② C、③ D、全部
21、把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生如下反应:
3 X (g)+Y (g) ![]() n Z (g)+2 W (g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.01mol/(L·min)。上述反应中Z气体的化学计量数n的值是
n Z (g)+2 W (g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.01mol/(L·min)。上述反应中Z气体的化学计量数n的值是
A、1 B、2 C、3 D、4
22、反应3Fe(s)+4H2O(g) ![]() Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A、增加Fe的物质的量 B、将容器的体积缩小一半
C、保持体积不变,充入Ne使体系压强增大 D、压强不变,充入Ne使容器的体积增大
23、对于相同物质的量浓度、相同体积的盐酸和醋酸,下列几种说法正确的是
A、它们的c(H+)不相同 B、各用水稀释一倍后,pH比较:盐酸<醋酸
C、分别和同浓度的氢氧化钠溶液反应至pH=7,所用氢氧化钠溶液的体积不同
D、各与足量的锌粒充分反应,产生H2的量不同
24、一定温度下,将a mol PCl5通入一个容积固定不变的密闭容器中,发生反应:
PCl5(g) ![]() PCl3(g)+Cl2(g),反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是
PCl3(g)+Cl2(g),反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是
A、2p1>p2 B、PCl5的分解率增大
C、p1<p2 D、Cl2的体积分数增大
25、用来表示可逆反应2A(g)+B(g) ![]() 2C(g)(正反应是放热反应)的正确图象是
2C(g)(正反应是放热反应)的正确图象是
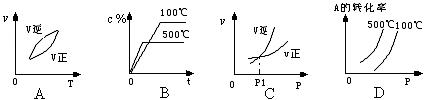
26、某温度下,在一容积可变的恒压反应容器中,反应2A(g)+B(g) ![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A、均减半 B、均加倍 C、均增加1mol D、均减少1mol
27、现有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.3mol/L,要使Mg2+转化Mg(OH)2,并使Mg2+与Al3+分离,至少需要4mol/LNaOH溶液的体积为
A、140mL B、120mL C、100mL D、80mL
28、将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A、c(HCN)<c(CN-) B、c(Na+)>c(CN-)
C、c(HCN)-c(CN-)=c(OH-) D、c(HCN)+c(CN-)=0.1mol/L
二、填空题
29.某二元弱酸(简写H2A)溶液,按下式发生一级和二级电离H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2-已知同浓度时H2A的电离程度大于HA-的电离程度,设有下列四种溶液:
H++A2-已知同浓度时H2A的电离程度大于HA-的电离程度,设有下列四种溶液:
A.0.01mol/L的H2A溶液 B.0.01mol/L的NaHA溶液
C.0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)c(H+)最大的是 ,最小的是 .
(2)c(H2A)最大的是 ,最小的是 .
(3)c(A2-)最大的是 ,最小的是 .
30.在硫化氢的饱和溶液中存在的电离平衡是:
H2S+H2O![]()
![]() +HS-,HS-+H2O
+HS-,HS-+H2O![]()
![]() +S2-
+S2-
(1)其中[HS-] [S2-],[HS-] [H+],[H+] [S2-](大于、小于或等于)
(2)若加NaOH固体,[S2-]将 ,S2-的物质的量将 溶液的PH值将 .
(3)若加入无水CuSO4,[S2-]将 ,电离平衡向 移动,溶液的PH值将 .
31.有A、B两瓶氨水,浓度分别为1mol/L和0.1mol/L,则A、B两瓶氨水中[OH-]的比 10.(用大于、小于、等于填写).其理由是 .
32.在某化工生产中要用到一种无色、可溶于水的晶体——铝铵矾.该晶体是一种复盐,其主要成分为十二水合硫酸铝铵.向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化.已知NH+4与AlO-2在水溶液中不能大量共存,会发生如下反应:![]() +
+![]() +H2O=Al(OH)3↓+NH3
+H2O=Al(OH)3↓+NH3![]() 试回答:
试回答:
(1)在硫酸铝铵水溶液中滴入石蕊试液,观察到的现象是 ,其原因是 .
(2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:①溶液中出现白色沉淀,②有刺激性气味的气体逸出;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀量逐渐减少.请回答出各种现象由先到后的顺序 .
(3)写出滴入NaOH溶液的过程中,有关反应的离子方程式:① ,② ,③ .
33.现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
(1)甲溶液为 溶液,其物质的量浓度为 .mol·L-1;乙溶液为 溶液,其物质的量浓度是 mol·L-1
(2)写出实验③的有关离子方程式 .
34.在CH3COOH的水溶液中加入少量固体CH3COONa后,溶液的PH值变 ;其原因是(用文字和相应的离子方程式简要叙述) .在该混合液中滴入少量稀H2SO4时,其PH值基本不变,原因是 .
35.将石墨电极A和B,浸入盛有200g10%的硝酸银溶液的烧杯中,将直流电源P、Q两极分别与A、B相连,通电一段时间后,A极因附着析出物质,而增至2.16g,则B极逸出气体质量为 g,电源的P极是 极,A极发生 反应,电解反应式为 ,此时硝酸银溶液的质量百分比浓度为 .
36.某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品ag,称取时使用的仪器名称为 .
(2)将样品溶解于足量的稀盐酸中,过滤,滤液中主要含有 ,滤渣中含有 ;在溶解、过滤时使用的仪器有 .
(3)往滤液中加入过量NaOH溶液,过滤.写出该步操作中有关的离子方程式 , , .
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称重质量为bg.有关的化学方程式为 , .
(5)该样品中铝的质量分数的表达式为 .
(6)若第(3)步中加入NaOH的量不足时,会使测定的结果(偏高、偏低、不影响) .
若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果(偏高、偏低、不影响) .
若第(4)步中对沉淀的灼烧不充分时,会使测定的结果(偏高、偏低、不影响) .
37、有一瓶澄清的溶液,其中可能含有NH4+ 、 K+ 、 Na+ 、 Mg2+、 Ba2+ 、 Al3+ 、Fe3+、Cl-、I-、 NO3-、CO32 -、S2- 、SO42- 、AlO2- 、SO32-、MnO4- , 取该溶液进行以下实验:
(1)、取PH试纸检验,溶液呈强酸性,可以排除 离子的存在。
(2)、取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,可以排除 离子的存在。
(3)、另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除 离子的存在。
(4)、取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明 离子存在,又可排除 离子存在。
(5)、将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:该溶液中肯定存在的离子是
肯定不存在的离子是
还不能确定是否存在的离子是
38、如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题。电解质A的水溶液焰色反应呈浅紫色。
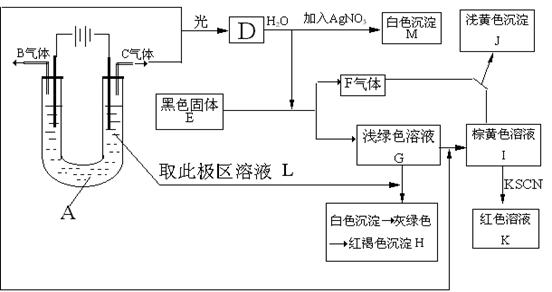
(1)、写出A的化学式为 ,E的名称为 。
(2)、I与F作用的离子方程式是
(3)、G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:
(4)、用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+ ①、
②、
39、一定条件下,可逆反应A2+B2![]() 2C达到平衡后,c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、gmol/L。请确定:
2C达到平衡后,c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、gmol/L。请确定:
⑴a、b应满足的关系式__________________
⑵若反应从正反应方向开始进行,当g=____________是,a有最大值为__________
⑶若反应从逆反应方向开始进行,当b=____________是,a有最小值为__________
⑷综合⑵、⑶的结论,可知本题中a的取值范围为____________________________。
三、计算题
40.称取某金属氧化物(MO)14.94g,将它溶于稀H2SO4中,然后再加蒸馏水稀释至250mL.取这种溶液50mL,加入适量其他物质,用铂做电极进行电解得到2.348g这种纯金属.试回答: (1)M是下列哪一种金属:Mg、Ni、Cu、Ca、Pb
(2)析出2.348g金属时,消耗多少摩电子?多少库仑电量?(每摩电子电量为96500库仑)
(3)最初溶液中,金属离子的摩尔浓度是多少?
高二化学期末综合练习题
参考答案:
一、1.AD 2.B 3.A 4.A 5.B 6.C 7.B 8.C 9.D 10 D 11 C 12 AB 13 B C 14 CD 15A 16 A
| 题号 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 答案 | B | C | A | D | A | AC | CD | A | AB | C | D | BD |
二、
29.(1)A;D (2)C;D (3)D;A 30.(1)大小 小于 大于 (2)增大 增大 增大 (3)减小 正向 减小
31.<,由题可知A溶液的浓度为B溶液浓度的10倍,但氨水为弱电解质,浓度越小,电离度越大,所以B溶液中[OH-]不是A溶液中[OH-]的![]() ,而要较
,而要较![]() 大些,故应填“<”.
大些,故应填“<”.
32.(1)变红;![]() 和Al3+水解显酸性 (2)①→③→②→⑤→④
和Al3+水解显酸性 (2)①→③→②→⑤→④
(3)①Al3++3OH-![]() Al(OH)3↓②
Al(OH)3↓②![]() +OH-
+OH-![]() NH3↑+H2O③Al(OH)3+OH-
NH3↑+H2O③Al(OH)3+OH-![]()
![]() +2H2O
+2H2O
33.(1)AlCl30.5mol·L-1;NaOH 0.5mol·L-1
(2)Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
Al(OH)3+OH-![]()
![]() +2H2O
+2H2O
34.(1)变大,CH3COONa完全电离出的![]() 使CH3COOH的电离平衡向左移动,使电离产生的H+浓度变小,PH值变大.
使CH3COOH的电离平衡向左移动,使电离产生的H+浓度变小,PH值变大.
(2)H2SO4完全电离的H+与溶液中较多的CH3COO-结合成CH3COOH分子,使溶液中的[H+]变化不大.
35.0.016g,负极,还原,Ag++e=Ag,8.4%
36.(1)5.8 (2)D (3)6.10 2.(1)天平;(2)AlCl3、MgCl2;Cu、Si;烧杯、玻璃棒、漏斗、带铁圈的铁架台(或漏斗架) (3)Mg2++2OH-![]() Mg(OH)2↓ Al3++4OH-
Mg(OH)2↓ Al3++4OH-![]()
![]() +2H2O
+2H2O
(4)NaAlO2+CO2+2H2O![]() Al(OH)3↓+NaHCO3
2Al(OH)3
Al(OH)3↓+NaHCO3
2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
(5)![]() ×100%
×100%
设原合金中含铝xg,关系式:
2Al———Al2O3
![]() =
=![]() x=
x=![]() b 所以合金中铝的质量分数为
b 所以合金中铝的质量分数为![]() ×100%
×100%
(6)偏低 偏高 偏高 加入NaOH的量不足时,有一部分Al(OH)3没有转化为AlO-2而损失,导致b值偏小,从而使测定结果偏低.
若不用蒸馏水洗涤沉淀,沉淀上会附有杂质,导致b值偏大,使测定结果偏高.若对Al(OH)3灼烧不充分时,有一部分Al(OH)3混入Al2O3中,导致b值偏大,使测定结果偏高.
37、 (1). CO32 -、S2- 、AlO2- 、SO32-(2). Fe3+、NO3-、MnO4-(3) . Mg2+、Al3+
(4) . Ba2+; SO42- (5) .I- 、NH4+ 、Ba2+ ; Mg2+、Al3+ 、Fe3+、NO3-、CO32 -、S2- 、SO42- 、AlO2- 、SO32-、MnO4-; K+ 、Na+、Cl-
38、(1)A:KCl E:硫化亚铁(2)2Fe3++H2S=2Fe2++S↓+2H+ (3) 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (4)①2Fe3++Cu=2Fe2++Cu2+、 Fe+Cu2+=Fe2++Cu↓
39、(1) a-b=0.4 (2) 0 1.3 (3) 1.8 0.4 (4) 0.4≤a≤1.3
40.
(1)![]() (2)3.78t 0.13t 2.(1)Ni (2)7720库仑 (3)浓度:0.8mol/L
(2)3.78t 0.13t 2.(1)Ni (2)7720库仑 (3)浓度:0.8mol/L