高二化学期中测试题
| 题 号 | 一 | 二 | 三 | 四 | 总 分 |
| 得分 |
(考试时间:60分钟)
一、选择题(本题包括8小题,第小题只有一个答案符合题,第题2分,共16分)
1.某品牌消毒液的商品标识上标明 ( )
①本品为无色液体呈碱性 ②使用时应加水稀释
③可对餐具进行消毒,并能漂白浅色衣物。据此判断其有效成分可能是
A.Cl2 B.SO2 C.H2O2 D.NaClO
2.在允许加热的条件下,只用一种试剂就可鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫
酸铁溶液,这种试剂是 ( )
A.NaOH B.NH3•H2O C.AgNO3 D.BaCl2
3.两次获得诺贝尔奖,在化学界享有盛名的科学家是 ( )
A.爱因斯坦 B.达尔文 C.居里夫人 D.欧拉
4.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是
①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反
应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是 ( )
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
5.在一定条件下RO3n-和氟气可发生如下反应. RO3n- + F2 + 2OH- = RO4- + 2F- + H2O
从而可知在RO3n-中,元素R的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
6.在常温下,下列可逆反应的平衡移动伴随有颜色的变化,但颜色变化不受压强变化影
响的是 ( )
A.2NO2 ![]() N2O4 B.2NO2
N2O4 B.2NO2 ![]() 2NO + O2
2NO + O2
C.2HI ![]() H2 + I2 D.FeCl3 + 3KSCN
H2 + I2 D.FeCl3 + 3KSCN ![]() Fe(SCN)2 + 3KCl
Fe(SCN)2 + 3KCl
7.若以![]() 1和
1和![]() 2分别表示浓度为a mol•L-1和b mol•L-1氨水的质量分数,且知2a = b,
2分别表示浓度为a mol•L-1和b mol•L-1氨水的质量分数,且知2a = b,
则下列推断正确的是(氨水的密度比纯水的小) ( )
A.2![]() 1
=
1
= ![]() 2 B.
2 B.![]() 1
= 2
1
= 2![]() 2 C.2
2 C.2![]() 1
<
1
< ![]() 2 D.
2 D.![]() 1<
1<![]() 2<2
2<2![]() 1
1
8.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气
体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的
氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02g B.8.51g C.8.26g D.7.04g
二、选择题(每小题3分,共30分,每小题有1-2个答案符合题意)
9.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验 ( )
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在原溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
10.反应SO2(g) + NO2(g)
![]() NO(g) + SO3(g)在一定条件下建立平衡,再加入一定量
NO(g) + SO3(g)在一定条件下建立平衡,再加入一定量
的O2,下列说法正确的是 ( )
A.平衡左移,容器内压强不一定增大
B.平衡右移,达到平衡时容器内压强不一定增大
C.平衡不一定移动,容器内压强一定增大
D.平衡右移,SO2的转化率提高
11.一定质量的铜和足量的浓硝酸或稀硝酸完全反应,在相同条件下用排水集气法收集
产生的 ( )
A.硝酸浓度越大,消耗的硝酸越少
B.硝酸浓度不同,生成Cu(NO3)2物质的量相同
C.硝酸浓度越大,产生的气体越少
D.用排水集气法收集到的气体在相同状况下体积相同
12.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温常压下,11.2L氧气所含的原子为NA
B.1.8g的NH4+离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为3NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
13.在一恒定的容器中充入2 mol A和1 mol B发生反应.2A(g) + B(g) ![]() XC(g)。达
XC(g)。达
到化学平衡后,C的体积分数为a。若在恒温恒压下,按0.6 mol A。0.3 mol B.
1.4 mol C为起始物质,达到化学平衡后,C的体积分数仍为a,则X的值可能为
( )
A.2 B.3 C.4 D.无法确定
14.在一密闭容器中,反应mA(g) + nB(g) ![]() pC(g)达到平衡时,测得c(A)为
pC(g)达到平衡时,测得c(A)为
0.5 mol•L-1;在温度不变的条件下,将容器体积增大一倍,当达到新的平衡时,测
得c(A)为0.3 mol•L-1;则下列判断正确的是 ( )
A.化学计量数.m + n > P B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
15.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡. ( )
Ca(OH)2(固) ![]() Ca2++2OH-,加入以下溶液,可使Ca(OH)2减少的是
Ca2++2OH-,加入以下溶液,可使Ca(OH)2减少的是
A.Na2S溶液 B.AlCl3溶液 C.NaOH溶液 D.CaCl2溶液
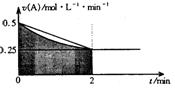 16.某溶液中发生反应:A=2B+C,A的反应速
16.某溶液中发生反应:A=2B+C,A的反应速
率v(A)与时间t的图象如图所示。若溶液的
体积为2L,且起始时只加入A物质,下列说
法错误的是
A.图中阴影部分的面积表示0—2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时.c(B)介于1mol·L-1 至1.5mol·L-1 之间
17.在一定条件下,向一密闭容器中通人一定量SO2和02的混合气体,即发生如下
反应:2SO2(g)+02(g)![]() 2SO3(g);△H<0。反应达平衡后,SO2、O2和SO3的物质的量之比为3:4:6,保持其他条件不变,降低温度后达到新的平衡时,O2和SO3的物质的量分别是1.1mol和2.0mol,此时容器内SO2的物质的量应是 ( )
2SO3(g);△H<0。反应达平衡后,SO2、O2和SO3的物质的量之比为3:4:6,保持其他条件不变,降低温度后达到新的平衡时,O2和SO3的物质的量分别是1.1mol和2.0mol,此时容器内SO2的物质的量应是 ( )
A.0.7mol B.0.9mol C.1.1 mol D.1.3mol
18.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域
作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引
起整个化学领域正在经历一场革命性的变化。下列说法正确的是 ( )
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
三、填空题
19.(7分)(1)磷在自然界里主要以 的形式存在于矿石中。磷的单质有多种同
素异形体,其中最常见的是有毒的 和无毒的 。
(2)磷在不充足的氯气中燃烧的化学方程式为:
______________________________________
而在过量的氯气中燃烧的化学方程式则是:
___________________________________________
(3)磷(原子量为31)在空气中燃烧生成的氧化物通常可用作强干燥剂。制备100g
这种干燥剂所消耗的空气的体积约为 L(在标准状况下)。
20.(6分)有NO2和N2O4常温常压下A.B.C.D均为气态。A与B可发生可逆反应:
A +
B ![]() C +nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在
C +nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在
不同条件下达到平衡时C的浓度如下
| 温度 | 压强(kPa) | C平衡浓度mol•L-1 |
| 25℃ | 100 | 1.0 |
| 25℃ | 200 | 1.8 |
| 25℃ | 300 | 3.2 |
| 25℃ | 400 | 6.0 |
(1)可逆反应中系数n的取值范围为______________理由 ________________________
(2)在500kPa时,D的状态可能为__________________________
21.(7分)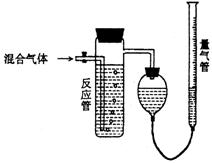 工业上测量SO2、N2、O2混合气体中
工业上测量SO2、N2、O2混合气体中
SO2含量的装置如下图;反应管中装有碘的淀
粉溶液。SO2和I2发生的反应为(N2、O2不与
I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的
水的体积等于 的体积(填写气体的
分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量 (选填:
偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标
准状况下的体积)。用C.VA.Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选
下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
22.(10分)Ⅰ 恒温、恒压下,在一个可变容积的容器中发生如下反应:(2003年江苏化学高考题)
A(气) + B(气) ![]() C(气)
C(气)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的量
______mol
(2)若开始时放入3molA和3molB,达到平衡后,生成C的物质的量______mol
(3)若开始时放x molA.2 mol B和1 mol C,到过平衡后,A和C的物质的量分别是
y mol和3a mol ,则x = ______ mol, y = ________ mol
平衡时,B的物质的量__________ (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2 mol
作出此类判断的理由是___________________________________________
(4)若在(3)的平衡混合物中再加入3 mol C,待再次到达平衡后,C的物质的量分数是____
Ⅱ 若维持温度不变,在一个与⑴反应前起始体积相同,且容积固定的容器中发生上述反应
(5)开始时放入1 mol A和1 mol B到达平衡后生成b mol C。将b与⑴小题中的a进行比________(选填一个编号)
(甲)a < b (乙) a > b (丙) a = b (丁)不能比较两者大小
作此判断的理由__________________________________________
|
请填写以下空白:
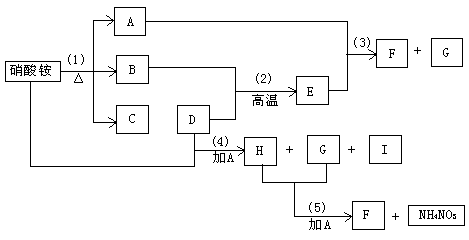
(1)D是_______,E是______,H是________。
(2)反应(4)和(5)的离子方程式是_____________________。
24.(5分)用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可
选择使用,N2和O2的用量可自由控制)。
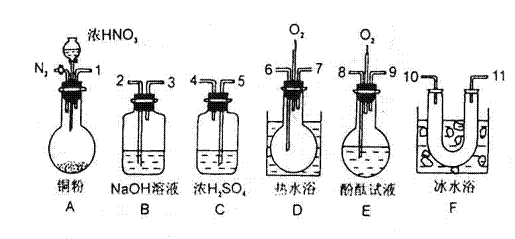
已知:①NO+NO2+2OH-→2NO2-+H2O②气体液化温度:NO2 21℃ NO -152℃
试回答:
(1)反应前先通入N2目的是
(2)确认气体中含NO的现象是
(3)装置F的作用是
(4)如果O2过量,则装置B中发生反应的化学方程式为:
四、计算题
25.(6分)3.2g Cu与过量硝酸 (a mol•L-1,20 mL )充分反应。硝酸的还原产物只有NO2、NO,反应后含H+为0.1 mol
(1)此时溶液中所含NO3-为________ mol
(2)求生成 的气体中NO2和NO的物质的量(用含a的式子表示)
26.(8分)合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1m3(标准状况)CH4按上式完全反应,产生H2 mol。
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=3︰1 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?
参考答案
一、选择题(本题包括8小题,第小题只有一个答案符合题,第题2分,共16分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | A | C | B | B | D | C | B |
二、选择题(每小题3分,共30分,每小题有1-2个答案符合题意)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| B | BD | BD | BC | AB | AC | B | C | A | A |
三、填空题
19、(1)磷酸盐 白磷 红磷
(2)2P+3Cl2![]() 2PCl3 2P+5Cl2
2PCl3 2P+5Cl2![]() 2PCl5
2PCl5
(3)188(空气中O2含量按21%计算)或197(空气中O2含量按1/5计算)
20、(n>1增加压强,平衡向逆方向移动,则n + 1 > 1+1,即n > 1;
21.(1)N2、O2的体积 (2)偏低 (3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也给分)
(5)bceg或beg或ceg
22、⑴1-a; ⑵3a ⑶2;3-3a;丁;无法判断平衡移动方向 ⑷![]() ⑸乙;略
⑸乙;略
23. (1)![]()
(2)![]() ;
;
![]()
24、(1)驱赶装置中空气,防止反应产生的NO被氧化
(2)通入O2后装置(D)中有红棕色气体生成
(3)分离NO和NO2(或使NO2液化)[说明:其它合理回答都给分]
(4)4NO2+O2+4NaOH=4NaNO3+2H2O
25、⑴0.2 ⑵NO2 = 0.03a – 0.2 NO = 0.045a – 0.35
26.(1)133.9 (2)3m3<V<4m3 (3)设H2O为Xmol,O2为Ymol
则:![]() X=10 Y=7.5
X=10 Y=7.5
VO2/VH3=(7.5+2.5)/15=2/3
(4)设富氧空气中O2的体积分数为a,反应用去的H2O(g)与富氧空气的体积分别为X、Y。
(3X+4aY)/[(1-a)Y]=3/1 X/Y=1-7/3a
(用其它方法解得也给分)