高二化学上学期(理)期中考试
可能用到的数据:H 1 N 14 O 16 Na 23 S 32
一、择题(本题包括8小题目,每小题只有一个答案符合题意,每题3分,共24分)
1. 第二次世界大战期间,某国侦察小分队到德国法西斯一座十分隐蔽且戒备森严的军火厂,上级要小分队在三天内必须炸毁它,结果他们十多只涂有化学药剂的老鼠完成了任务.据你推测这种药剂是
A、黑火药和酒精 B、白磷和二硫化碳溶液
C、高锰酸钾和硫酸 D、硝酸铵和水
2.
在密闭容器中放入NO2,在25℃时以下平衡2NO2(g)
![]() N2O4(g)(正反应是放热反应),把此容器置于100℃的沸水中,则下列哪性质不会改变
N2O4(g)(正反应是放热反应),把此容器置于100℃的沸水中,则下列哪性质不会改变
A、颜色 B、平均分子量 C、质量 D、压强
3. 下列含氮的氧化物中称为硝酐的是
A、NO B、N2O3 C、NO2 D、N2O5
4下列反应起了氮的固定作用的是
A、N2和H2在一定条件下反应生成NH3 B、NO和O2反应生成NO2
C、NH3经催化氧生成NO D、由NH3制碳铵和硫铵
5 下列关于氮的叙述中不正确的是
A、氮有多种化合价电子 B、液氮可作冷冻剂
C、氮分子为非极性分子 D、 氮气的性质活泼,在常温下能与H2、O2反应.
6 下列不能勒夏特列的原理解的是
A、棕红色NO2加压后颜色先变深后变浅
B、在H2、I2(g)和HI组成的平衡体系中加压后,混和物颜色加深
C、冰镇啤酒打开瓶塞后产生大量泡沫
D、Fe(SCN)3溶液中加入固体KSCN后颜色加深
7 实验室制取下列气体时,与实验室取氨气的气体发生装置相同的是
A、CO2 B、H2 C、Cl2 D、O2
8 在2A+B=3C+4D的反应中,下列表示该反应的化学反应速率最快的是
A、V(A)=0.5 mol/L·s B、V(B)=0.3 mol/L·s
C、V(C)=1.0mol/L·s D、V(D)=1.1 mol/L·s
二、选择题(每小题有一个或两个选择符合题意,每小题4分,共48分;若正确的选项包括两个,选项一个且正确的得2分,选两个且都正确的得4分,错选项,多选该小题即为0分。)
9.N2+3H2![]() 2NH3合成氨反应中在下列情况下不能使反应速率加快的是:
2NH3合成氨反应中在下列情况下不能使反应速率加快的是:
A、加入N2 B、减小压强扩大容器体积
B、加入催化剂 D、降低温度
10.有关白磷与红磷的述,下确的是
A、白磷是白色状体,不溶于水和CS2
B、红磷是红棕色粉末状固体,不溶于水易溶于CS2
C、白磷有毒,着火点而红磷无毒,着火点比白磷高得多
D、白磷转化为红磷是找物理变化
11.检验固体样品中是否含有NH4+的方法是,先取少量固体于试管中,然后
A、加热,用湿润红色石蕊试纸在试管口检验
B、加入溶有解,用红色石蕊试纸检测溶液酸碱性
C、加入弱碱溶液,加热,热诚滴入酚酞试剂
D、加入烧碱溶液,加热,用湿润石蕊试纸在试管口检验
12.铜粉放入稀H2SO4中,加热后无变化,当加入一种盐后,铜粉质量减少,而溶液变蓝,同时有气体生成,此盐是
A、氯化物 B、硫酸盐 C、硝酸盐 D、碳酸盐
13.在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g)+dW(g),反应达到平衡后,将气体体积压缩到原来的一伴,当再次达到平衡时,W的浓度为原平衡状态时的1.8倍.下列述下确的是
cZ(g)+dW(g),反应达到平衡后,将气体体积压缩到原来的一伴,当再次达到平衡时,W的浓度为原平衡状态时的1.8倍.下列述下确的是
A、平衡向逆反应方向移动 B、(a+b)>(c+d)
C、Z的体积分数变大草原 D、X的转化率变小
14.实验室里可按图1所示的装置干燥.储存气体R,多的气体可用水收,则R是
A、NO2 B、HCl C、CH4 D、NH3
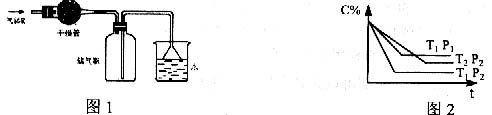
15.已知可逆反应:mA(g)+nB(g)![]() xC(g),在密闭容器中进行,图2表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
xC(g),在密闭容器中进行,图2表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
A、 T1>T2,P1<P2,m+n>x,正反应为放热反应
B、 T1<T2,P1<P2,m+n<x,正反应为吸热反应
C、 T1>T2,P1<P2,m+n<x,正反应为放热反应
D、T1<T2,P1>P2,m+n>x,正反应为吸热反应
16.某温度下,在体积一定的密闭容器中适量的NH3和Cl2恰好完全反应。若反应产物只有N2和NH4Cl固体,则反应前后容器中的压强比接近于
A、1:11 B、11:1 C、7:11 D、11:7
17.在一恒定的容器中充入2mol A和1mol B发生反应:
2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为:
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为:
A、可能为2 B、可能为3 C、只能是2 D、无法确定
18.在一定条件下RO3n-和氟气可发生如下反应:
RO3n-+F2+2OH-= RO4-+2F-+H2O从而可知在RO3n-中,元素R的化合价是
A、+4 B、+5 C、+6 D、+7
19.对于xA(g)+yB(g)![]() zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是
zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是
A、x+y>z+w,正反应是放热反应
B、x+y>z+w,正反应是吸热反应
C、x+y<z+w,逆反应是放热反应
D、x+y<z+w,逆反应是吸热反应
20.硝酸铜是制备Cu-Zn-AI系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用
①Cu与稀硝酸反应制取,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取,Cu+4HNO3=Cu(NO3)2+2NO2↑+4H2O
③通氧气于铜屑与稀硝酸的体系中制取,2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法不正确的是
A、制取相同量的硝酸铜需硝酸的量③最少
B、制取相同量的硝酸铜①产生的有毒气体比②少
C、三种方案中硝酸的利用率③>②>①
D、三种方案的反应都可以在铁制容器中进行
三、填空题:(共20分)
21.(4分)浓硝酸常常显黄色是因为其中混中_______杂质;浓硝酸使金属铝发生钝化是因为它具有__________性;稀硝酸与Cu反应的离子方程式为________________________________。
![]()
![]()
![]()
![]()
![]()
![]() 22.(6分)已知下列反应方程式(系数未配平),回答有关问题:
22.(6分)已知下列反应方程式(系数未配平),回答有关问题:
![]() Mg+ HNO3
Mg(NO3)2+ NH4NO3 +
Mg+ HNO3
Mg(NO3)2+ NH4NO3 +
(1)完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)硝酸在反应中显示出来的性质是__________(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)0.10mol镁溶解,则转移的电子数为______________________。
23.(10分)在一定温度上,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如右图),容器中发生以下反应:N2+3H2![]() 2NH3+
2NH3+![]() ,若反应达平衡后,测得混合气体为7体积。据此回答问题:
,若反应达平衡后,测得混合气体为7体积。据此回答问题:
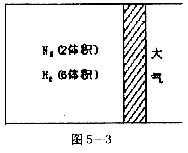
(1)若保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果应达到平衡后混合气体中各物质的量分数仍与上述平衡时完全相同,那么:①a=1,c=2,则b=___________,在此情况下,反应起始向__________方向进行(填“正”或“逆”)。②若需规定反应起始时向逆方向进行,则c的取值范围是__________________。
(2)在上述装置,若需控制平衡后混合气体为6.5体积,则可采取的措施是__________,原因是________________________________________。
四、计算题(8分)
24.在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与气体的体积(标准体积)的关系。试计算:
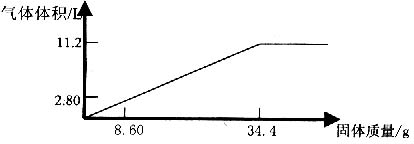
(1)NaOH溶液的物质的量的浓度是___________mol·L-1
(2)当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为_______________L(标准状况)
(3)当NaOH溶液180mL,固体仍为51.6g时,充分反应产生的气体为_______________L(标准状况)
高二化学上学期(理)期中考试答案
一、选择题
1 B 2 C 3 D 4 A 5 D 6 B 7 D 8 C
二、选择题
9 BD 10 C 11 D 12 C 13 AD 14 D 15 C 16 B 17 AB 18 B 19 BD 20 CD
三、填空题:
21.NO2 (1分)强氧化性(1分) 3Cu+2NO3-+8H+===3Cu2++2NO↑+4H2O(2分)
22.(1)4、10、=4、1、3、H2O(4分) (2)④(1分)(3)1.204×1023(1分)
23.(10)(1)3 (1分) 逆(2分) 1<c≤4(3分)
(2)降温;(2分)温度降低,平衡向放热方向移动。气体体积减小的方向是放热反应方向(2分)
四、计算题
24.(1)5.00molL-1(2分) (2)15.7L(3分) (3)16.8L(3分)
说明:要求保留三位有效数字,每有一处不保留扣1分。