高二化学上学期期考
命题教师:倪正元
注:本卷可以使用计算器,所有答案一律做(第四页)答卷页上。
可能要用的相对原子质量:N:14 Cu:64 S:32
一.选择题(1—20题一个答案,21—25题可能1—2答案)50%
1. 下列关系不正确的是
A、 非金属性:N>P>As>Sb>Bi
B、 酸性:HNO3>H3PO4>H3AsO4>H3SbO4>H3BiO4
C、 稳定性:NH3<PH3<AsH3<SbH3<BiH3
D、稳定性:HCl>H2S>PH3>SiH4
2. 在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的量之比为
A、1:2 B、2:1 C、1:3 D、3:1
3. 1L0.1mol·L-1氨水中所含溶质微粒的物质的量是
A、0.1molNH3分子
B、0.1molNH3·H2O分子
C、NH3分子和NH3·H2O分子约共0.1mol
D、NH3分子、NH3·H2O分子、![]() 离子共0.1mol
离子共0.1mol
4. 关于白磷和红磷的下列说法中,不正确的是
A、白磷和红磷在一定条件下可以相互转化 B、燃烧产物均相同
C、都溶于二硫化碳 D、保存方法不同
5. 木炭屑与浓HNO3共热,产生的气体等分为①和②两份,将第一份气体先导入适量蒸馏水中再导入石灰水中,将第二份气体直接导入石灰水中,则石灰水的变化可能是
A、①不变浑浊,②变乳白色 B、①变乳白色,②不变浑浊
C、①变乳白色,②变乳白色 D、①不变浑浊,②变淡黄色
6. NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成N2和CO2,对此反应,下列叙述中正确的是
A、使用催化剂不能改变反应速率 B、降低压强能使反应速率加快
C、改变压强对反应速率没有影响 D、升高温度能加快反应速率
7. 在一定条件下,反应2A(g)+2B(g)⇋3C(g)+D(g)达到平衡状态的标志是
A、 单位时间内生成2n molA,同时生成n molD
B、 容器内的压强不随时间而变化
C、 单位时间内生成n molB,同时消耗1.5n molC
D、容器内混合气体密度不随时间而变化
8. 亚硝酸(HNO2)参加化学反应,既可作氧化剂,也可作还原剂,当它作为氧化剂时,可能生成的产物有
A、NH3 B、N2O5 C、N2O3 D、NO2
9. 不同浓度的硝酸溶液分别跟足量的金属锌完全反应,生成的还原产物分别是NO2、NO、NH4NO3,若这些产物的物质的量相等时,则参加各反应的硝酸物质的量之比是
A、1:2:2 B、1:2:3 C、1:2:4 D、1:2:5
10.硫酸铵在强热条件分解成NH3、N2、SO2、H2O,反应中生成的氧化产物与还原产物的
物质的量之比是
A、1:3 B、2:3 C、1:1 D、4:3
11.在同温同压下,可逆反应N2O4(g)⇋2NO2(g)达到平衡时的气体体积是最初体积
的1.3倍,则N2O4的分解率是
A、30% B、60% C、40% D、47%
12.下列盛放试剂的方法,错误的是
A、把硝酸放在棕色试剂瓶中,并放置在冷暗处 B、把硝酸银放在棕色试剂瓶中
C、把白磷保存在水中 D、把氨水盛放在金属容器中
13.在某温度下,反应ClF(g)+F2(g)⇋ClF3(g)(正反应是放热反应)在密闭容器中达到平衡。
下列说法正确的是
A、温度不变,缩小体积,ClF的转化率增大
B、温度不变,增大体积,ClF3的产率提高
C、升高温度,增大体积,有利于平衡向正反应方向移动
D、降低温度,体积不变,F2的转化率降低
14.工业废气中的氮氧化合物是造成大气污染的主要来源之一,为保护环境,工业上常通入
氨与之发生如下反应NOx+NH3![]() N2+H2O(未配平,NOx表示氮的氧化物的平均化学式),从而使之转化为无毒的N2,现有NO、NO2混合气体3L,可用同温同压下3.5LNH3恰好使之转化为N2。则原混合气体中NO和NO2物质的量之比为
N2+H2O(未配平,NOx表示氮的氧化物的平均化学式),从而使之转化为无毒的N2,现有NO、NO2混合气体3L,可用同温同压下3.5LNH3恰好使之转化为N2。则原混合气体中NO和NO2物质的量之比为
A、1:3 B、3:1 C、1:2 D、1:1
15.将硝酸分解的气体产物通入水中,充分作用后
A、放出NO2 B、放出NO C、放出O2 D、无气体放出
16.反应Fe+HNO3→Fe(NO3)3+H2O+ ,若铁跟起氧化作用的硝酸的物质的量之比为4:3,
则方框内的物质是
A、NO2 B、NO C、N2O D、N2
17.2mol/L的盐酸与硫酸各100mL,分别加入等质量的铁粉,反应结束后,所生成的气体质
量之比为2:3,则往盐酸中加入铁粉的质量是
A、2.8g B、8.4g C、11.2g D、5.6g
18.蘸有浓氨水的玻棒靠近下列各浓酸时,均有白烟产生的一组是
A、HCl、H2SO4、HNO3 B、HCl、HBr、HNO3
C、HCl、H3PO4、HNO3 D、HCl、H3PO4、H2SO4
19.某温度下,反应N2O4(气)⇋2NO2(气)-Q(Q>0)在密闭容器中达到平衡。下列说法中不正确的是
A、加压时(体积变小),将使正反应速率增大
B、保持体积不变,加入少许NO2将使正反应速率减小
C、保持体积不变,加入少许N2O4,再达平衡时,颜色变深
D、保持体积不变,升高温度,再达平衡时颜色变深
20.用焦炭、水、空气为原料制氨气的化学方程式如下:1)C+H2O(g)![]() CO+H2;
CO+H2;
2)CO+ H2O(g)![]() CO2+H2;3)N2+3H2
CO2+H2;3)N2+3H2![]() 2NH3,参加反应的焦炭和氨气之间的物质的量之比是
2NH3,参加反应的焦炭和氨气之间的物质的量之比是
A、3:4 B、3:2 C、2:3 D、1:2
21.可逆反应3A(g)⇋3B(?)+C(?)-Q(Q>0)随着温度的升高,气体平均相对分子质量有变小趋势,则下列判断中正确的是
A、B和C可能都是固体 B、B和C一定都是气体
C、若C为固体,则B一定是气体 D、B和C可能都是气体
22.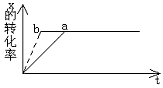 图中,a曲线表示一定条件下可逆反应X(g)+Y(g)⇋2Z(g)+W(s)(正反应是放热反应)的反应过程。若使a曲线变
图中,a曲线表示一定条件下可逆反应X(g)+Y(g)⇋2Z(g)+W(s)(正反应是放热反应)的反应过程。若使a曲线变
为b曲线,可采取措施是
A、适当催化剂 B、增大Y的浓度
C、降低温度 D、增大体系压强
23.在铁和铜的混和物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1 g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是
A、m1一定大于m2 B、m1可能大于m2
C、m1可能等于m2 D、m1一定等于m2
24.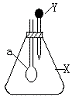 右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会儿可见小气球a鼓气。下列叙述中正确的是
右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会儿可见小气球a鼓气。下列叙述中正确的是
A、X是NH3,Y是浓氨水
B、X是SO2,Y是氢氧化钠浓溶液
C、X是CO2,Y是稀硫酸
D、X是HCl,Y是NaNO3稀溶液
25.一些装有化学物质的瓶子上贴有危险警告标签。下面是一些危险警告标签,则装有浓硝酸的瓶上应贴
二.填空题
26.配平下列反应的化学方程式并填空:
1) NH3+ O2![]() NO+ H2O,若有1.204×1024个电子发生转移,则被还原的物质的
NO+ H2O,若有1.204×1024个电子发生转移,则被还原的物质的
量是_______________mol。
2)在下列反应中, KNO2![]() K2O+ NO↑+ O2↑,当有22.4LNO(S.T.P)生成
K2O+ NO↑+ O2↑,当有22.4LNO(S.T.P)生成
时,则被氧化的氧原子的物质的量是_______________mol。
3)配平下列化学方程式 Fe+H2SO4(浓)![]() Fe2(SO4)3+ SO2↑+ H2O被还原的
Fe2(SO4)3+ SO2↑+ H2O被还原的
H2SO4与未被还原的H2SO4物质的量之比是____________。
27.1)16.8gCu与30mL 98%的浓H2SO4(ρ=1.84 g/cm3)完全反应,可生成硫酸铜
____________克,其中有多少____________克硫酸被还原。
2)在容积为3L的密闭容器中盛有N2和H2,在一定条件下发生反应,经过5min后达到
化学平衡,此时容器中含有0.9molN2, 1.2molH2, 3molNH3,则H2起始浓度为____________,H2的转化率____________用H2表示的反应速率![]() =____________,平衡时混合气体的平均相对分子质量为____________。
=____________,平衡时混合气体的平均相对分子质量为____________。
3)有可逆反应A(g)+B(g)⇋3C(g),下图分别表示在不同条件下,生成物C在反
应混和物中的百分含量(C%)和反应时间(t)的关系图
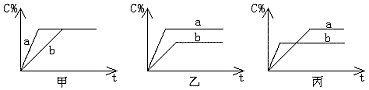
按下述要求填空写答案(A)甲图中两条曲线分别表示有无催化剂时的情况,则_ __________曲线表示无催化剂;(B)若乙图曲线a表示200℃和b表示100℃的情况,则该可逆反应的正反应是____________热反应;(C)若丙图中两条曲线分别表示不同压强下的情况,则____________曲线是表示压强较大时的情况。
4)将VmLNO和NO2的混和气通过水吸收后,得到a mL无色气体A,将此无色气体A
与等体积O2体积混合,再通过水充分吸收后,收集到5mL无色气体B,试回答:
①A气体是____________,B气体是____________
②A气体的体积是____________mL
③V的取值范围是____________
28.有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保
持恒压;B容器为固定体积。起始时向这两个容器中分别充入等量的体积比为2:1的SO2和O2的混合气,并使A、B容器中气体体积相等。在保持400℃条件下发生反应:2SO2+O2⇋2SO3,并达到平衡。
1)达到平衡所需时间A容器比B容器________,两容器中SO2的转化率A比B______。
2)达到(1)所述平衡后,若向容器中通入数量不多的等量氩气,A容器的化学平衡
____________移动,B容器的化学平衡____________移动。
3)达到(1)所述平衡后,若向容器中通入等量的原混合气,重新达到平衡后,A容器中SO3
的体积分数____________,B容器中SO3的体积分数____________。
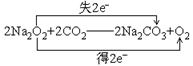
29.据下图装置进行实验,回答下列问题。
1)在受热的试管中A处的Na2O2
发生反应的化学方程式(并标出
电子转移方向和数目):
①________________________
②________________________
2)被加热的铂丝处发生反应的化学方程式________________________
3)B管内出现的现象____________
4)烧杯C中发生的现象____________________________________
5)B管、烧杯C中可能发生的主要反应的方程式________________________
三.计算题
30.标准状况下,用一充满氨气的圆底烧瓶做喷泉实验,实验完毕后,圆底烧瓶中充入水的体积为其容积的4/5,
1)求圆底烧瓶中NH3的体积分数
2)求所得氨水一物质的量浓度
3)若测得上述氨水的密度为0.95g/cm3,求此氨水中溶质的质量分数
31.在373K时,把0.125molN2O4气体通入体积为500mL的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2含量为0.01mol,进行到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍,则求:
1)开始2s内,以N2O4表示的反应速率
2)达平衡时,体系的压强是开始时的多少倍?
3)N2O4的平衡浓度
4)平衡后,若压缩容器体积,再达平衡后NO2的浓度如何变化。
附加题
32.喷泉是自然界中的一种现象。在实验室中,利用气体和溶剂的某种性质,在一特定装置中,也能模拟自然界的现象,形成美丽的喷泉。
1)烧瓶已充满某种气体X,气体体积为1000mL(273K,
101325Pa),烧杯中盛满水,直导管长L=60cm,导管
进入烧杯12cm,气体的溶解度在273K时为1:40
(1体积水能溶解101325Pa下气体40体积)。实验
开始,胶头滴管先向烧瓶中注入1mL水,通过计算
确定能否看到喷泉现象。假设压强的微小变化对气体溶解度的影响可忽略不计。
2)某学生试图用氨气和水去做喷泉实验,结果实验失败。试分析实验失败的可能原因。
第一学期期中考试高二化学答卷页
可能要用的相对原子质量:N:14 Cu:64 S:32
一.选择题(1—20题一个答案,21—25题可能1—2答案)50%
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | ||||||||||
| 题号 | 21 | 22 | 23 | 24 | 25 | |||||
| 答案 | ||||||||||
二.填空题(共38分)
26.(9分)
1)____NH3+____O2![]() ____NO+____H2O, _______________mol。
____NO+____H2O, _______________mol。
2)____KNO2![]() ____K2O+____NO↑+____O2↑,
_______________mol。
____K2O+____NO↑+____O2↑,
_______________mol。
3)____Fe+____H2SO4(浓)![]() ____Fe2(SO4)3+____SO2↑+____H2O __________
____Fe2(SO4)3+____SO2↑+____H2O __________
27.(15分)
1)硫酸铜__________g, __________g硫酸被还原
2)__________,__________,![]() =__________ __________
=__________ __________
3)(A)__________ (B)__________ (C)__________
4)①A气体是____________________,B气体是____________________
②A气体体积是____________________
③V的取值范围是____________________
28.(6分)
1)____________________ ____________________
|
3)____________________ ____________________
29.(8分)
1)①____________________________________________________________
②____________________________________________________________
2)______________________________________________________________________
3)______________________________________________________________________
4)______________________________________________________________________
5)______________________________________________________________________
三.计算题(共12分)
30.
31.
附加题(10分)
32.
上学期高二化学期考答案
一.选择题(1—20题一个答案,21—25题可能1—2答案)50%
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | D | C | B | D | A | A | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | D | A | A | D | C | B | B | B | A |
| 题号 | 21 | 22 | 23 | 24 | 25 | |||||
| 答案 | CD | AD | A | BD | CD | |||||
二.填空题(共38分)
26.(9分)
1)4NH3+5O2![]() 4NO+6H2O, 0.5mol。
4NO+6H2O, 0.5mol。
2)4KNO2![]() 2K2O+4NO↑+ O2↑, 0.5mol。
2K2O+4NO↑+ O2↑, 0.5mol。
3)2Fe+6H2SO4(浓)![]() 1Fe2(SO4)3+3SO2↑+6H2O 1:1
1Fe2(SO4)3+3SO2↑+6H2O 1:1
27.(15分)
1)硫酸铜42g, 25.2g硫酸被还原
2)1.9mol/L,78.94%,![]() =0.3mol/L·min 15.4
=0.3mol/L·min 15.4
3)(A)6 (B)吸 (C)b
4)①A气体是NO,B气体是O2
②A气体体积是20mL
③V的取值范围是20<V<60
28.(6分)
1)短 大 2)逆向 不 3)不变 升高
 29.(8分)
29.(8分)
1)(1)
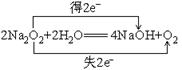 (2)
(2)
2)4NH3+5O2![]() 4NO+6H2O 3)变红棕色 4)紫色石蕊变红
4NO+6H2O 3)变红棕色 4)紫色石蕊变红
5)2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
三.计算题(共12分)
30.1)4/5 2)1/22.4(mol/L) 3)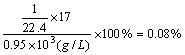
31.1)![]() 2)1.6倍
2)1.6倍
3)![]() 4)增大
4)增大
附加题:(10分)
32.根据题意1mL水最多能溶解40mL气体X,容器内压约减至
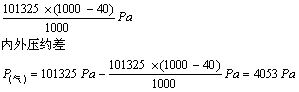
导管水柱高h=60cm-12cm=48cm
P(水)=![]() gh=1×9.8×480=4704(Pa)
gh=1×9.8×480=4704(Pa)
P(气)<![]() (水)不能看到喷泉现象
(水)不能看到喷泉现象
失败原因:收集NH3时空气未排尽,装置漏气,烧瓶潮湿,滴入烧瓶里的水有少,导管又偏长