高二化学第一学期期末考试卷
高二化学试题
考试时间:120分钟 满分:150分
可能用到的原子量:H: 1 C: 12 O: 16 Mg: 24 Al: 27 Fe: 56
第Ⅰ卷
一、本题包括8小题;每小题4分,共32分。每小题只有一个选项符合题意。
1、下列各组物质中,可以用分液漏斗分离的是 ( )
A.苯和己烷 B.苯和溴苯 C.己烷和水 D.酒精和水
2、下列各组物质中,肯定是同系物的是 ( )
A.C3H6和C4H10 B.C2H6和C4H10 C.C3H6和C2H6 D.C3H6和C4H8
3、制取一氯乙烷最好的方法是 ( )
A.乙烷和氯气反应 B.乙烯和氯气反应
C.乙烯和氯化氢反应 D.乙烷和氯化氢反应
4、不能用金属跟盐酸反应直接得到的盐是 ( )
A.FeCl3 B.AlCl3 C.MgCl2 D.ZnCl2
5、除去镁粉中混有的铝粉,可选用的试剂是 ( )
A.盐酸 B.硝酸 C.氨水 D.氢氧化钠溶液
6、只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,这种试剂是 ( )
A.BaCl2溶液 B.FeCl2溶液 C.Fe(NO3)3溶液 D.FeCl3溶液
7、用水稀释0.1 mol/L氨水时,溶液中随水量的增加而减小的是 ( )
A.c (H+) · c (OH-) B.c (OH-) C.c (OH-) / c (NH3 · H2O) D.c (H+)
8、在铁的吸氧腐蚀中,发生还原反应的那个电极上进行的电极反应是( )
A.2H+ + 2e-= H2 B.2H2O + O2 + 4e-= 4OH-
C.Fe - 2e-= Fe2+ D.4OH- - 4e-= 2H2O + O2
二、本题包括10小题,每小题4分,共40分。(每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分,若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分。但只要选错一个,该小题不得分。)
![]() 9、一定温度下,可逆反应A(g)
+ B(g) C(g) + D(g)达到平衡的标志是 ( )
9、一定温度下,可逆反应A(g)
+ B(g) C(g) + D(g)达到平衡的标志是 ( )
A.反应混合物中,A、B、C、D的浓度相等
B.单位时间内生成a mol C,同时生成a mol D
C.C的生成速率与D的消耗速率相等
D.反应混合物中,A、B、C、D的质量分数不再变化
![]() 10、下图中a曲线表示一定条件下的可逆反应 X (g) + Y (g) 2Z
(g) + W(s),正反应放热的反应过程。若使a曲线变为b曲线,可采取的措施是
( )
10、下图中a曲线表示一定条件下的可逆反应 X (g) + Y (g) 2Z
(g) + W(s),正反应放热的反应过程。若使a曲线变为b曲线,可采取的措施是
( )
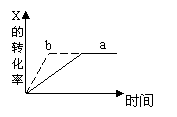 A.增大压强
A.增大压强
B.增大X的浓度
C.升高温度
D.加入催化剂
11、下列溶液肯定是酸性的是 ( )
A.含H+的溶液 B.pH<7的溶液
C.使酚酞显无色的溶液 D.c (OH-) < c (H+)的溶液
12、25℃时,若pH = a的10体积的某强酸溶液与pH = b的1体积的某强碱溶液混合后,溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系是 ( )
A.a + b = 14 B.a + b = 13 C.a + b = 15 D.a + b = 7
13、把0.02 mol/L的CH3COOH溶液和0.02 mol/L NaOH溶液以等体积混合,混合液中微粒浓度关系正确的为 ( )
A.c (Na+) = c (CH3COO-) B.c (H+) + c (Na+) = c (OH-) + c (CH3COO-)
C.c (H+) > c (OH-) D.c (CH3COO-) + c (CH3COOH) = 0.02 mol/L
14、下列各组溶液,只用试管和胶头滴管,不用任何其它试剂就可以鉴别的是 ( )
A.CaCl2和Na2CO3 B.稀H2SO4和Na2CO3
C.AlCl3和KOH D.Ba(OH)2和NaHSO4
15、甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入的铝粉质量为 ( )
A.1.8g B.3.6g C.5.4g D.7.2g
16、向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL 1.0 mol/L的盐酸,恰好使混合物完全溶解,放出224 mL的气体(标准状况)。所得溶液中加KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是 ( )
A.2.8g B.5.6g C.8.4g D.11.2g
17、甲苯苯环上的一个氢原子被烃基-C3H7所取代,可能得到的一元取代物有 ( )
A.3种 B.4种 C.6种 D.8种
18、下列各组化合物中,不论二者以什么比例混合,只要总质量一定,则完全燃烧时生成水的质量不变的是 ( )
A.CH4、C2H6 B.C2H4、C3H6 C.C3H6、C6H6 D.C2H2、C6H6
第Ⅱ卷
一、单项选择题:4×8 = 32分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
二、不定项选择题:4×10 = 40分
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三、本题包括2小题,共20分:
19、(8分)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,某学生设计下列实验以确认上述混合气体中有乙烯和二氧化硫。
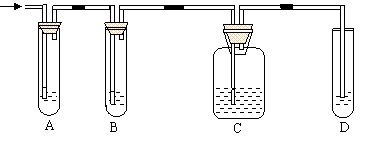 |
(1)实验室制乙烯反应方程式为:
(2)图中A、B、C、D装置可盛放的试剂是:①品红溶液 ②浓H2SO4 ③NaOH溶液④酸性KMnO4溶液,填写有关试剂的序号:
A 、B 、C 、D
(3)证明混合气体中的确含有乙烯的现象是
。
20、(12分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
①用碱式滴定管移取25 mL烧碱溶液于锥形瓶中,并滴加几滴酚酞试剂;
②在250 mL的容量瓶中定容成250 mL烧碱溶液;
③在天平上准确称取烧碱样品 w g,在烧杯中加蒸馏水溶解;
④将物质的量浓度为c mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为v1 mL;
⑤在锥形瓶下垫一张白纸,滴定到终点,记录终点耗酸体积v2 mL。
回答下列问题:
(1)正确的操作步骤的顺序是(用①、②、③、④、⑤表示) ;
(2)滴定操作时眼睛应注视 ;
(3)若酸式滴定管没有用标准H2SO4润洗对测定结果有何影响?
(填“偏高”、“偏低”、或“无影响”,下同),若锥形瓶在滴定前预先用水润洗后未干燥,则滴定结果 。
(4)若在配制250 mL烧碱溶液时,不慎多加了一些水,超过瓶颈的刻度线,如何补救?
;
(5)该烧碱样品的纯度的计算式为 。
四、本题包括4小题,共44分:
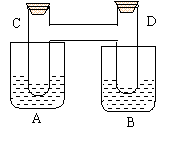 21、(10分)如图所示在烧杯A、B中均盛有20℃、50mL水,试管C与D相通,其
21、(10分)如图所示在烧杯A、B中均盛有20℃、50mL水,试管C与D相通,其![]() 中充有红棕色气体,处于下列平衡2NO2
N2O4 (正反应放热)。当向A中加入10g NaOH固体使其溶解,往B中加入50g硝酸铵也使其溶解(20℃时,硝酸铵的溶解度为197g),则:
中充有红棕色气体,处于下列平衡2NO2
N2O4 (正反应放热)。当向A中加入10g NaOH固体使其溶解,往B中加入50g硝酸铵也使其溶解(20℃时,硝酸铵的溶解度为197g),则:
(1)A、B烧杯中,A杯溶液温度 ,
B杯溶液温度 (填升高、降低、不变)
(2)试管C中气体颜色变 ,D中气体颜色
变 ;(填“深”、“浅”、“不变”)
(3)在测定NO2相对分子质量时,下列条件较为适宜
的是
A.温度25℃,压强1.01×105Pa B.温度0℃,压强5.05×104Pa
C.温度130℃,压强5.05×103Pa D.温度130℃,压强3.03×105Pa
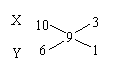
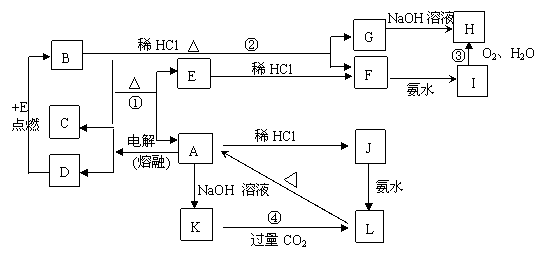 22、(12分)A~L为中学化学中的常见物质,它们有如图所示转化关系,其中A为坚硬难熔的主族元素的化合物,B为黑色晶体,则
22、(12分)A~L为中学化学中的常见物质,它们有如图所示转化关系,其中A为坚硬难熔的主族元素的化合物,B为黑色晶体,则
(1)写出物质的化学式
B 、 E 、 H 、K ;
(2)书写反应方程式:
①
②
③
④
![]()
23、(14分)(1)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。则分子式为CnH2n+2的烃分子中碳与碳间共用电子对数为 ,分子式为CnH2n-6的烃分子中碳与碳间共用电子对数为 ;
(2)十个碳原子以内的烷烃其一氯代物只有一种的烷烃有 种;
(3)分子相对质量为128的烃的分子式为 、 等;
(4)已知碳原子数小于或等于6的单烯烃与HBr反应,加成产物只有一种结构,符合此条件的单烯烃有 种。在这些烯烃中,若与H2加成后,所得烷烃的一卤代物的同分异构体有2种,则该烯烃的结构简式为 。
24、(8分)HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种,现有一定量Al粉和Fe粉的混合物与100 mL稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入2 mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示:
则(1)混合物与HNO3反应
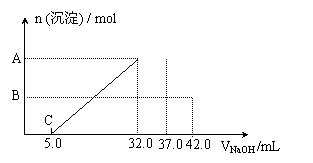 后Fe元素的化合价为
;
后Fe元素的化合价为
;
 (2)纵坐标A点数值
(2)纵坐标A点数值
B点数值 ;
(3)原HNO3溶液的物质的量的浓度
mol/L。
五、计算题:(包括2小题,共14分)
25、(6分)某FeCl3溶液200 mL中放入10.4g铁钉,15min后取出铁钉质量变为4.8g,其溶液仍为200 mL,将上述溶液分成两等份后,一份加KSCN溶液,未见血红色;另一份加入过量的NaOH溶液,充分反应并放置10min。问:
(1)加入NaOH溶液前的溶液的溶质的物质的量浓度为多少?
(2)加入NaOH溶液后最多生成沉淀多少克?
26、(8分)常温下呈气态的饱和烃X与不饱和烃Y的混合气体
对氢气的相对密度为28.5。已知X与Y中含碳原子数相同:
(1)求X、Y的化学式及X与Y的体积比。
(2)若150℃和1.01×105Pa下;将1L该混合气体与7L氧气混合后
充入密闭容器中充分燃烧并恢复到原来状况,则此时混合气体总体积
为多少升?
高二化学期终试卷参考答案
一、
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | B | C | A | D | D | B | B |
二、
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| CD | AD | D | C | B | BC | C | A | C | BD |
三、(共2小题,20分)
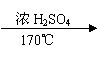 19、(8分)
19、(8分)
(1)CH3CH2OH CH2=CH2↑+ H2O (2分)
(2)①、③、①、④ (1分×4)
(3)C中溶液不褪色,D中溶液褪色 (2分)
20、(12分)(每空2分)
(1)③②①④⑤
(2)锥形瓶中溶液颜色的变化
(3)偏高、无影响
(4)倒掉重配
(5)w (NaOH)
=  ×100%
×100%
或w (NaOH) = ![]()
![]() %
%
四、(共4小题,44分)
21、(10分)(每空2分)(1)升高,降低 (2)深,浅 (3)C
22、(12分)(1)(每空1分): Fe3O4,Fe,Fe(OH)3,NaAlO2
![]() (2)(每空2分)
(2)(每空2分)
①3Fe3O4 + 8Al ═ 9Fe + 4Al2O3
②Fe3O4 + 8HCl ═ FeCl2 + 2FeCl3 + 4H2O
③4Fe(OH)2 + O2 + 2H2O ═ 4Fe(OH)3
④NaAlO2 + CO2 + 2H2O ═ NaHCO3 + Al(OH)3↓
23、(14分)(每空2分)
(1)n-1,n + 3(2)4(3)C9H20、C10H8
![]() (4)4, CH3CH=CHCH3、CH3 — C = C — CH3
(4)4, CH3CH=CHCH3、CH3 — C = C — CH3
24、(8分)(每空2分)
(1)+3 (2)0.018,0.008 (3)0.84 mol/L
五、(共2小题,14分)
25、(6分)
解:(1)据题意 FeCl3完全转化为FeCl2(1分)设FeCl3物质的量为x
2Fe3+ + Fe = 3Fe2+
2 1
x (10.4-4.8)/56
解得x = 0.2 mol 生成n Fe2+ = 0.3 mol
c(FeCl2) = ![]() = 1.5 mol/L (2分)
= 1.5 mol/L (2分)
(2)200 mL溶液两等份后,nFe2+
= 0.3 mol ×![]() = 0.15 mol(1分)
= 0.15 mol(1分)
Fe2+ + 2OH- = Fe(OH)2, 4Fe(OH)2 + O2 + H2O = 4Fe(OH)3
故m(沉淀) = 0.15 mol × 107 g/mol = 16.05g (2分)
26、(8分)
 解:
解: ![]()
![]() = 28.5 × 2 = 57
g/mol 平均分子式为C4H9 ,X必为C4H10(2分)
= 28.5 × 2 = 57
g/mol 平均分子式为C4H9 ,X必为C4H10(2分)
(1)设Y为C4H8
![]() = 1:1(1分)
= 1:1(1分)
若Y为C4H6
![]() =3:1(1分)
=3:1(1分)
(2)150℃ 1.01×105Pa时 H2O为气体
![]() =
= ![]() +
+![]() +
+![]() = 4
= 4![]() +
+ ![]() +[7-(4+
+[7-(4+![]() )]
)]![]()
= 9.25![]() (4分)
(4分)