高二化学第一学期期末试题(文科)
(时间100分钟 满分100分)
可能用到的相对原子质量:H-1、C-12 N-14、O-16、Al-27、Sn-119、Fe-56
第I卷 (选择题共 60分)
一、选择题(本题包括30小题,每小题只有一个选项符合题意,每小题2分,共60分。)
1.在下列过程中,需要加快化学反应速率的是
A.钢铁腐蚀 B.食物腐败 C.炼钢 D.塑料老化
2.下列气体不会造成大气污染的是
A.二氧化硫 B.氮气 C.一氧化碳 D.一氧化氮
3.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖,关于NO的下列叙述不正确的是
A.NO是红棕色气体 B.NO可以是某些含高价N物质还原的产物
C.NO不是亚硝酸酐 D.NO可以是某些含低价N物质氧化的产物
4.向下列溶液滴加稀硫酸,生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是( )
A Na2SiO3 B BaCl2 C FeCl3 D NaAlO2
5.下列液体pH>7的是
A.胃液 B.食醋 C. 葡萄汁 D.人体血液
6.在48ml0.1mol/LHNO3溶液中加入12ml0.4mol/LKOH溶液,所得溶液呈
A.弱酸性 B.强酸性 C.强碱性 D.中性
7.进行下列各反应,要得到相同质量的Cu(NO3)2 ,消耗HNO3的物质的量最大的是
A.铜和浓硝酸反应 B.铜和稀硝酸反应
C.氧化铜和硝酸反应 D.氢氧化铜和硝酸反应
8.铜粉放入稀硫酸溶液中,加热无明显现象发生,当加入一种盐后,铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,此盐是
A.NaCl B.Na2CO3 C.KNO3 D.MgCl2
9.下列说法中,正确的是
A.凡能导电的物质一定是单质
B.金属单质都能与稀硫酸发生置换反应
C.活泼金属都能从盐溶液中置换出较不活泼的金属
D.在化学反应中,金属失电子,常作还原剂
10.要使氯化铝溶液中的Al3+完全转化成Al(OH)3沉淀,最适宜试剂是
A.NaOH溶液 B.稀HCl
C.氨水 D.AgNO3溶液
11.能直接由金属单质与酸反应得到的盐是
A.Fe(NO3)3 B.CuCl2
C.FeCl3 D.AgCl
12.下列说法中正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
13.只用一种试剂就能把AgNO3、KSCN、稀H2SO4、NaOH溶液区别,该试剂是( )
A、BaCl2溶液 B、FeCl2溶液 C、FeCl3溶液 D、Fe(NO3)3溶液
14.铁片投入下列溶液中反应后,金属片质量减少但无气体产生的是( )
A、冷稀HNO3 B、Cu(NO3)2溶液 C、稀H2SO4 D、Fe(NO3)3溶液
15.甲、乙、丙、丁分别是Al2(SO4)3、、FeSO4、NaOH、BaCl2四种物质中的一种,若将甲溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A 、Al2(SO4)3 B、NaOH C、 BaCl2 D、FeSO4
16.把14ml 2mol/L的Al2(SO4)3溶液慢慢滴入30ml 6mol/L的NaOH溶液中,并不断搅拌,随Al2(SO4)3逐滴加入,所产生的现象是( )
A、白色沉淀-----沉淀增加
B、白色沉淀----沉淀增加----部分溶解
C、白色沉淀-----沉淀随即溶解-----澄清溶液
D、白色沉淀-----沉淀随即溶解-----不再溶解-----沉淀增加
17.相同物质的量浓度的(a)NaOH、(b)HCl、(c)NH4Cl、(d)Na2CO3、(e)KNO3溶液,它们的pH由大到小的顺序
A、c>b>e>d>a B、a>d>e>b>c C、d>a>c>b>e D、a>d>e>c>b
18、用蒸馏水稀释0.1mol/L的HAc溶液到0.001mol/L,随溶液的稀释(T不变),下列各项中始终保持增大趋势的是( )
A、[CH3COOH] B、[H+]、[CH3COO-]
C、[H+]/[CH3COOH] D、[CH3COOH]/[CH3COO-]
19.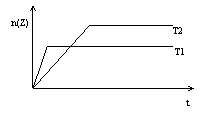 反应2X(g)+Y(g)
反应2X(g)+Y(g) ![]() 2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如右图。下列判断正确的是
2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如右图。下列判断正确的是
A. T1<T2 , 正反应为放热反应
B. T1>T2 ,正反应为放热反应
C. T1>T2 ,逆反应为吸热反应
D. T1<T2 ,逆反应为放热反应
20.常用于衡量一个国家石油化工发展水平的标志是
A、石油产量 B、乙烯产量 C、天然气产量 D、汽油产量
21.下列反应的离子方程式正确的是
A.铝片踉氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
22.用化学方法鉴别Fe2+和Fe3+两种离子,可选用的试剂是:
A、KSCN溶液 B、石蕊 C、盐酸 D、观察颜色
23.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是
A、NH4+、Al3+、SO42-、NO3- B、K+、Na+、AlO2-、NO3-
C、Na+、NH4+、MnO4-、SO42- D、Na+、K+、NO3-、HSO3-
24.铁丝与氧气或水蒸气反应的共同产物是
A、FeO B、Fe2O3 C、Fe3O4 D、FeO和Fe3O4
25.下列物质不属于合金的是
A、黄金 B、白银 C、钢 D、水银
26.在2A+B ![]() 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) = 0.3 mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)= 1 mol·L-1·S-1
27.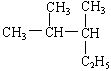 的名称是
的名称是
A.2—甲基—3—乙基丁烷 B.3,4—二甲基戊烷
C.2,3—二甲基—4—乙基丙烷 D.2,3—二甲基戊烷
28.下列互为同系物的是
A.金刚石和石墨 B.![]() C.乙烷和丙烷 D.T2O和D2O
C.乙烷和丙烷 D.T2O和D2O
29.A、B、C都是金属,把A放入C盐溶液时,A的表面附着一层C;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为
A、A>B>C B、A>C>B C、B>A>C D、B>C>A
30.下列物质中,不能使溴水和高锰酸钾酸性溶液褪色的是
A、C2H4 B、C3H6 C、C5H12 D、C4H8
第Ⅱ卷(非选择题,共40分)
二、填空题(26分)
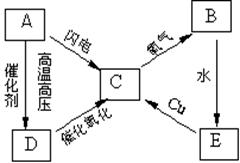 31.(14分)右图表示A、B、C、D、E五种含氮物质相互转化的关系图。其中A、B、C、常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。
31.(14分)右图表示A、B、C、D、E五种含氮物质相互转化的关系图。其中A、B、C、常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。
(1)各物质的化学式为:
A、 B、 C、 D、 E、
(2)各步反应的化学方程式为:
A→C: D→C:
B→E: E→C:
32.(8分).写出下列反应方程式,并判断反应类型
(1)由乙烯制备聚乙烯
(2)苯与硝酸和浓硫酸混合酸反应
33.(4分)分别完全燃烧1molC2H6、1molC2H4、1molC2H2,需要氧气最多的是 ,生成水最多的是 。
三.实验题
34.(5分)实验室通常用固体氯化铵和熟石灰共热制取氨气。请填写下列空白。
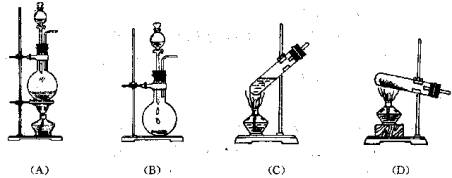
(1)上图中,用于该实验制取氨气的气体发生装置是__________(填标号)
(2)收集氨气的方法是_________ (填标号)。
A.向下排空气法 B.向上排空气法 C. 排水法
(3)制取氨气的化学方程式是_________________________________
。
(4)干燥氨气时,可选用的干燥剂是________ (填标号)。
A.浓硫酸 B. 碱石灰 C.五氧化二磷
四、计算题(本题共9分)
35.将11.2L(标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了5.6g 。求原气体混合物中乙烯与乙烷的物质的量比。
36.某高炉每天生产含铁96%的生铁70t,计算需用含20%杂质的赤铁矿多少吨。
高二化学(文科)答题卡
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
二、填空题
31.(1)各物质的化学式为:
A、 B、 C、 D、 E、
(2)各步反应的化学方程式为:
A→C: D→C:
B→E: E→C:
32.(1)由乙烯制备聚乙烯
(2)苯与硝酸和浓硫酸混合酸反应
33. , 。
三.实验题
(1)上图中,用于该实验制取氨气的气体发生装置是__________(填标号)
(2)收集氨气的方法是_________ (填标号)。
(3)制取氨气的化学方程式是_________________________________
。
(4)干燥氨气时,可选用的干燥剂是________ (填标号)。
四、计算题
35.
36.
参考答案
一、选择题(本题包括30小题,每小题只有一个选项符合题意,每小题2分,共60分。)
1.C 2. B 3. A 4. D 5. D 6.D 7. A 8. C 9. D 10. C 11. A 12. C 13. C 14. D 15. D 16. A 17. D 18. C 19. B 20. B 21. C 22. A 23. A 24. C 25. D 26. B 27. D 28. C 29. C 30. C
二、填空题31.A、N2 B、NO2 C、NO D、NH3 E、HNO3
 A→C: N2 +O2═2NO
D→C:4NH3 + 5O2
A→C: N2 +O2═2NO
D→C:4NH3 + 5O2 ![]() 4NO +6H20
4NO +6H20
| |
32
|
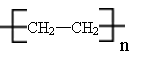 .
.
====
+HNO3
![]() +H2O
+H2O
33.C2H6 C2H6
三.实验题34.
(1)D (2)A
(3)2NH4Cl﹢Ca(OH)2![]() CaCl2﹢2NH3↑﹢H2O
CaCl2﹢2NH3↑﹢H2O
(4)B
四、计算题35。2:3,36 。60t.