高二化学第一学期期末质检复习题(理科)1
(时间120分钟 满分100分)
可能用到的相对原子质量:H-1、C-12 N-14、O-16、Na-23、Mg-24、Al-27、S-32、Cl-35.5、K-39、Fe-56、I-127、Ba-137
第I卷(选择题共 50分)
一、选择题(本题包括25小题,每小题只有一个选项符合题意,每小题2分,共50分。)
1.不属于氮的固定的变化是
A.根瘤菌把氮气转化为氮气 B.氮气和氢气在适宜条件下合成氨
C.氮气和氧气在放电条件下合成NO D.工业上用氨和二氧化碳合成尿素
2.下列说法正确的是
A.酸性氧化物一定是非金属氧化物 B.碱性氧化物一定是金属氧化物
C.非金属氧化物一定是酸性氧化物 D.金属氧化物一定是碱性氧化物
3.下列物质的水溶液中,pH值大于7的是
A.Na2CO3 B.NH4NO3 C.Na2SO4 D.KNO3
4.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是
A.NaOH B.NH3·H2O C.AgNO3 D.BaCl2
5.欲使氨水中,氨分子浓度增大,则应加入的试剂是
A.水 B.醋酸 C.氯化钠 D.氯化铵
6.反应4A(气)+5B(气)![]() 4C(气)+6D(气) (正反应为放热反应)在一定温度下达到化学平衡状态时,下列说法正确的是
4C(气)+6D(气) (正反应为放热反应)在一定温度下达到化学平衡状态时,下列说法正确的是
A.单位时间里生成n molC,同时生成n molD
B.若升高温度最终能生成更多的C和D
C.单位时间里有4n molA消耗,同时有5n molB生成
D.容器里A、B、C、D的浓度比是4:5:4:6
7.某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A.10% B.15% C.20% D.25%
8. Al3+离子能在下列物质的溶液中比较稳定地存在的是
①KOH、②NH3、③NaCl、④CuSO4、⑤Cl2
A.①② B.①②③ C.③④⑤ D.②③
9.能正确表示下列化学反应的离子方程式是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
10.波尔多液不能用铁制的容器盛放,是因为铁能与农药中的硫酸铜起反应。在该反应中
A.铁是氧化剂 B.铁是还原剂
C.铁被还原 D.铁是还原产物
11.将镁、铝、铁分别投入到等质量的过量稀H2SO4中, 反应结束后各溶液的质量仍然相等, 则投入的镁、铝、铁三种金属的物质的量关系为
A.mAl>mMg>mFe B.mMg>mAl>mFe
C.mFe> mMg >mAl D.mAl=mMg= mFe
12.将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A.3mol/L HC1 B. 4mol/L HNO3
C.8 mol/L NaOH D.18mol/LH2SO4
13.在下列溶液中持续通人CO2,产生不溶物且不会消失的是
A.饱和NaCl溶液 B.Ca(OH)2溶液
C.CaCl2溶液 D.饱和Na2CO3溶液
14.钢铁发生腐蚀时,正极上发生的反应是
A.2Fe-4e— =2Fe2+ B.2Fe2++4e— =2Fe
C.2H2O+O2+4e—=4OH— D.Fe3++e—=Fe2+
15.下列电离方程式正确的是
A.NH3·H2O ==NH3+H2O B.CuCl2==Cu2++Cl—
C.NaHCO3==Na++HCO3—
D.H2S![]() 2H++S2—
2H++S2—
16.用一定物质的量浓度的NaOH溶液,使物质的量浓度和体积均相同的FeSO4、Fe2(SO4)3溶液中的Fe2+、Fe3+完全沉淀,则所消耗的NaOH的体积之比为
A.1:3 B.2:3 C.1:6 D.1:2
17.增大压强,对已达到平衡的下列反应产生的影响是
3X(g)+Y(g)![]() 2Z(g)+2Q(S)
2Z(g)+2Q(S)
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都没有变化,平衡不发生移动
18.在密闭容器中,放入5mol H2,3mol N2以合成氨,平衡时生成氨为2mol,则平衡时压强是起始时压强的
A.1.3倍 B.2倍
C.0.75倍 D.0.25倍
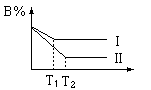 19.对于如下的反应: mA+nB
19.对于如下的反应: mA+nB![]() pC+qD当其它条件不变,温度分别为T1和T2时,反应物B的含量与反应时间(t)的关系分别可用图中曲线I和曲线II表示,据此下列判断正确的是
pC+qD当其它条件不变,温度分别为T1和T2时,反应物B的含量与反应时间(t)的关系分别可用图中曲线I和曲线II表示,据此下列判断正确的是
|
C.T2>T1 正反应是吸热反应 D.T2>T1 逆反应是吸热反应
20.铜与1mol/L的HNO3溶液反应,如果NO3-下降了0.2mol/L,则H+ 同时下降
A.0.2 mol/L B.0.4 mol/L C.0.3 mol/L D.0.8 mol/L
21.Na3N是离子化合物,它与水作用产生NH3,下列叙述不正确的是
A.Na3N与盐酸反应可产生两种盐
B.在Na3N与水反应中,Na3N作还原剂
C.Na + 与N 3-电子层结构与氩原子结构相同
D.Na + 半径比N 3-半径小
22.向含1molKAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使溶液中的SO42—恰好完全沉淀,则最后生成Al(OH)3的物质的量是
A.1mol B.1.33mol C.0.667mol D.0mol
![]()
![]()
![]() 23.用
的
溶液30ml恰好将
离子还原,则元素X的还原产物中的化合价是
23.用
的
溶液30ml恰好将
离子还原,则元素X的还原产物中的化合价是
A.+1 B.+2 C.+3 D.+4
24.下列各组离子,在溶液中不能大量共存的是
A.NO3- Fe2+ Cl- H+ B.Na+ OH- NH4+ AlO2-
C. Al3+ NO3- S2- OH- D.K+ OH- Na+ S2-
25.有人曾建议用AG表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)]。下列表述正确的是
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,岩溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
▲请将选择题答案填入下表!
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第II卷(非选择题 共50分)
二、(本题包括3小题,共15分)
26(3分).完成并配平下列化学方程式:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
该反应的电子转移数为 。
27(4分).写出Mg(HCO3)2,Ca(HCO3)2分别与过量的NaOH反应的离子方程式:
(1)
(2)
28(8分)pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强
碱与强酸的体积比是:______________;若所得混合液的PH=11,则强碱与强酸的体积比是:___________. PH=2的盐酸与
PH=5的盐酸等体积混合后所得溶液的PH为________,PH=8的氢氧化钾溶液与 PH=11的氢氧化钾溶液等体积混合后所得溶液的PH为_________.
三、(本题包括3小题,共14分)
29(2分).下列各物质的溶液物质的量浓度均为0.1mol/L.
①HCl ②NaOH ③Na2CO3 ④CH3COONa
⑤NH4Cl ⑥Ba(OH)2 ⑦KCl ⑧CH3COOH
按它们pH由小到大的排列顺序为
(填代号).
30(7分).现有A、B、C、D四瓶无色溶液,它们分别是磷酸钠、硝酸、碳酸钠和氯化钙。将其两两混合,现象如下:
(1)将A和B混合,B和C混合,都有沉淀产生。
(2)将A和D混合有气体产生。
试推断:A是________;B是________;C是________;D是________。
有关离子方程式为:
(1)________________________________________
(2)________________________________________
(3)________________________________________
31(5分).将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)

① 适量
过滤 过滤 ③
②
(1)沉淀A是 ,沉淀C ,沉淀E是
(2)加入试剂①是 ,③是_________。
四、(共11分)
32(2分).下列操作会引起实验误差的是 (填序号)
A.进行中和滴定时,直接向刚洗净的锥形瓶中加待测液
B.滴定未知浓度盐酸所用的0.05mol/L NaOH溶液, 在配制标准液称量NaOH固体时因与
空气接触吸收了少量的水蒸气和CO2
C.用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂
D.往洗净的滴定管中,直接加入标准液.
33.(8分)某学生为测定氯化铵和硫酸铵混合物中氯化铵的含量,按下图所示实验步骤进行实验
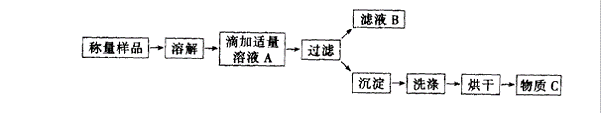
简答下列问题:
(1)溶液A中溶质的化学式______________,物质C的化学式是_______________。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码16g,游码为0.4g,则右盘样品实际质量是__________g。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是_______________。
(4)证明A溶液滴加适量的操作方法是_________________________________________ _
________________________________________________。
(5)若物质C的质量为23.3g,则原混合物中NH4Cl的质量分数为________________________。
四、计算题(共10分)
34.(3分)在10ml Al2(SO4)3溶液中逐滴加入4mol/L NaOH溶液,当滴至20ml溶液由浑浊恰好变为澄清,则Al2(SO4)3溶液的物质的量浓度为 ___ mol/L。
35.为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:IO3-+5I-+6 H+→3I2+3H2O I2+2S2O32-→2I-+S4O62-
参考答案及评分标准
一、选择题(本题包括25小题,每小题只有一个选项符合题意,每小题2分,共50分。请将答案填入下表!)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | B | A | A | D | C | D | C | A | B | A | A |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| D | C | C | A | C | C | A | D | B | D | D | D | D |
二、(本题包括3小题,共15分)
26. 1 6 14 = 2 2 6 3 7 H2O (2分) 6e- (1分)
27. Mg2+ + 2HCO3- + 4OH- = Mg(OH)2 ↓+ 2CO32- + 2H2O
Ca2+ + 2HCO3- + 2OH- = CaCO3 ↓+ CO32- +2H2O ( 各2分,共4分)
28.1 :10 11 :9 2.3 10.7 ( 各2分,共8分)
三、(本题包括3小题,共14分)
29(2分). ①⑧⑤⑦④③②⑥
30(各空1分,共7分). 碳酸钠 氯化钙 磷酸钠 硝酸
(1)3Ca2+ + 2PO43- = Ca3(PO4)2↓
(2)Ca2+ + CO32- = CaCO3↓
(3)2H+ + CO32- = CO2 ↑+ H2O
31(各空1分,共5分).(1)AgCl Mg(OH)2 Al(OH)3 (2)NaCl HCl
四、(共11分)
32(3分).B、D
33(共8分)
(1)BaCl2 ,BaSO4 (2分) (2)15.6 (1分) (3)玻璃棒(1分)
(4)取上层清液,加入BaCl2溶液无沉淀。 (2分) (5)15.38% (2分)
四、计算题(共9分)
34.(3分) 1.0
35(6分)
解:I2+2S2O32-→2I-+S4O62-
![]() (2分)
(2分)
IO3-+5I-+6 H+→3I2+3H2O
![]() (2分)
(2分)
每千克食盐中含KIO3:
![]() (2分)
(2分)
∴该加碘食盐是合格的