高二化学第一学期期中测验
(必修加选修)
班别________ 姓名_________ 学号_____ 成绩_________
第一部分选择题(72分)
可能用到的原子量:H:1 N:14 O:16 Na:23 S:32 C:12
Ba:137 Zn:65
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、下列反应起了氮的固定作用的是 ( )
(A)NH3经催化氧化生成NO (B)由NH3制碳铵和硫铵等化肥
(C)N2与H2在一定条件下反应生成NH3 (D)NO与O2反应生成NO2
2、碱石灰和五氧化二磷均能干燥的一组气体是 ( )
(A) N2 O2 NH3 (B) CO NO H2
(C) H2 NO NH3 (D) NO Cl2 N2
3、加适量的酸或碱都不能使下列离子浓度变小的是( )
A、Mg2+ B、NO3- C、S2- D、HCO3-
4、为了客运安全,下列物质①硝铵②硫铵③氯化钾④过磷酸钙⑤氯酸钾⑥硝酸钾⑦白磷⑧汽油,从化学性质上判断,由于易燃易爆不能带上火车的是 ( )
(A)①②④⑥⑧ (B)①⑤⑥⑦⑧ (C)①③⑥⑦⑧ (D)①②⑤⑦⑧
5、将2molSO2和1molO2混合于密闭容器中,在一定条件下发生反应:
2SO2+O2![]() 2SO3, 平衡时SO3为nmol。相同条件下,分别按下列配比在容器中放入起始物质,达平衡时,SO3的物质的量仍为nmol的是( )
2SO3, 平衡时SO3为nmol。相同条件下,分别按下列配比在容器中放入起始物质,达平衡时,SO3的物质的量仍为nmol的是( )
A.2molSO3 +2molSO2 B.2molSO2+1molO2+2molSO3
C.2molSO3+1molO2 D.1molSO2+0.5molO2+1molSO3
6、仪器中刻度位置正确的是( )
A、25ml碱式滴定管的25ml刻度在最下端
B、量筒0刻度在筒底最下平面上
C、托盘天平游码刻度尺的0标线位于中央
D、容量瓶体积标线刻于瓶颈上呈圈状水平环
7、A、B、C为三种气体,把amolA和bmolB充入一密闭容器中,发生反应
A+2B![]() 2C,达平衡时,若它们的物质的量满足n(A)+n(B)=n(C),则A的 转化率 ( )
2C,达平衡时,若它们的物质的量满足n(A)+n(B)=n(C),则A的 转化率 ( )
A、(a+b)/5·100% B、2(a+b)/5b·100%
C、2(a+b)/5·100% D、(a+b)/5a·100%
8、24ml浓度为0.05mol/L的Na2SO3溶液,恰好与20ml浓度为0.02mol/L的
K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
A、+6 B、+3 C、+2 D、0
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9、用标准盐酸溶液滴定NaOH溶液实验操作中,结果偏低的是( )
A、滴定管用蒸馏水洗净后,未用标准盐酸溶液洗即装标准盐酸溶液
B、锥形瓶用待测的NaOH溶液洗
C、滴定管尖嘴处留有气泡,滴定后气泡消失
D、滴定前平视滴定管读数,滴定后俯视滴定管读数
10、在一定温度下进行的可逆反应:A(g)+B(g)![]() C(g)达到平衡时的标志
C(g)达到平衡时的标志
是 ( )
A.单位时间生成nmolA,同时生成nmolB
B.单位时间生成nmolA,同时生成2nmolC
C.容器内气体的总压强不随时间变化
D.容器内气体的总质量不随时间变化
11、若溶液中有水电离产生的[OH -]=1×10-14mol/L,满足此条件的溶液中一定
可以大量共存的离子组是
A. Al3+ Na+ NO3- Cl- B. K+ Na+ Cl- NO3-
C. K+ Na+ Cl- AlO2- D. K+ NH4+ SO42- NO3-
12、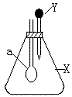 右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液 体Y滴入瓶中,振荡,过一会儿可见小气球a鼓气。下列叙述中 正确的是
右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液 体Y滴入瓶中,振荡,过一会儿可见小气球a鼓气。下列叙述中 正确的是
A、X是NH3,Y是浓氨水
B、X是SO2,Y是氢氧化钠浓溶液
C、X是CO2,Y是稀硫酸
D、X是HCl,Y是NaNO3稀溶液
13、能正确表示下列化学反应的离子方程式是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.硫化钠溶于水中:S2-+2H2O=H2S↑+2OH -
D.碳酸镁溶于硝酸中;CO32-+ 2H+=H2O+ CO2↑
14、已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+ →Fe2+ ; MnO4-→ Mn2+ ; Cl2→ 2Cl-; HNO2 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是 ( )
(A) Fe3+ (B) MnO4- (C) Cl2 (D) HNO2
15、反应X(g)+3Y(g) ![]() 2Z(g)+热量,在不同温度T、不同的压强P(P1>P2) 下达到平衡时,混合气体中Z的百分含量随温度变化的曲线为( )
2Z(g)+热量,在不同温度T、不同的压强P(P1>P2) 下达到平衡时,混合气体中Z的百分含量随温度变化的曲线为( )
Z% Z% Z% Z%
![]()
![]()
![]()
![]()
![]()
![]() P2
P1
P2
P1
![]()
![]()
![]()
![]() P1
P2
P1
P2
![]()
![]() P1
P2
P1
P2
P2 P1
![]()
![]()
![]()
![]() T
T
T
T
T
T
T
T
A B C D
16、将1.92g铜粉与一定量浓硝酸反应,随着铜的不断减少,反应生成的气体 颜色也逐渐变浅,当铜粉反应完全时,共收集到1.12L(标准状况下)气体, 则反应中消耗硝酸的物质的量是 ( )
A、0.12mol B、0.11mol C、0.09mol D、0.08mol
17、在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和PH都相等,
向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌等量
D.反应开始后乙烧杯中的[H+]始终比甲烧杯中的[H+]小
18、PH=1的两种酸溶液A、B各1ml,分别加入水稀释到1000ml,其PH值与溶 液体积(V)的关系如图所示,下列说法正确的是( )
A、A、B两种酸溶液的物质的量浓度一定相等
![]() B、稀释后,A酸溶液的酸性比B酸溶液强 PH
B、稀释后,A酸溶液的酸性比B酸溶液强 PH

![]()
![]() C、若a=4,则A是强酸,B是弱酸
a
A
C、若a=4,则A是强酸,B是弱酸
a
A
D、若1<a<4,则A、B都是弱酸
![]() B
B
![]()
![]() 1
1
![]() 0
0
1000(ml)
第二部分选择题(78分)
三、(本题包括2小题,共28分)实验题
19、用中和滴定的方法测定NaOH和NaCO3混合液中的NaOH含量时,可先在混合
液中加过量的BaCl2溶液,使Na2CO3完全转化为BaCO3沉淀,然后用标准
HCl溶液滴定(用酚酞作指示剂)。回答下列问题:
(1)向混有BaCO3沉淀的NaOH溶液中滴入HCl,为什么不会使BaCO3溶解
而且还可以测定NaOH的含量___________________________________
______________________________________。
(2)滴定终点时,溶液颜色如何突变_____________________________。
(3)在此实验中,若没有滴定管量取混合液,可用什么仪器来代替______
_______________
(4)下列操作,能引起测定结果偏高的是______________
A、滴定前用标准液润洗滴定管
B、滴定结束后俯视滴定管读数
C、滴定前用待测液润洗锥形瓶
D、若用甲基橙作指示剂
20、 实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐 酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:
![]() NaNO2+NH4Cl=NaCl
+ NH4NO2
NaNO2+NH4Cl=NaCl
+ NH4NO2
NH4NO2 N2↑+2H2O。
制取装置如图所示:
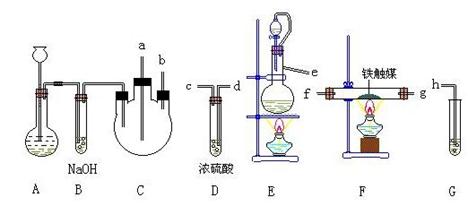
(1)装置A用于制取 ;B装置的作用是___________________________;
C 装置的作用是____________________________________.。
(2)装置E中分液漏斗上方常用导管与园底烧瓶相通,作用 是 。装置E与装置C直接相连,连接时导管口连接方法为e接 。
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:
另一接口 接 , 接 , 接 。
(4)装置D的作用为 。装置F导出的气体的成分为
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下 (填“能”或“不能”),理由是 。
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应与 相连为佳。
四、(本题包括4小题,共28分)填空题
21、在一定温度下,密闭容器中A+B![]() 2C类型的反应达到了平衡
2C类型的反应达到了平衡
(1)当增加或减少A物质时,平衡不移动,则A的物质状态为__________;
(2)升高温度,平衡向右移动,此正反应是______热反应;升高温度时,正
反应速率_________,逆反应速率__________(填增大、减少或不变)。
(3)若B物质为气态,增加压强时平衡不移动,则A物质为_____态,C物质为______态
22、配平下列氧化-还原反应的化学方程式,并填空:
P4+ CuSO4+ H2O--- Cu+ H3PO4+ H2SO4
氧化剂是 ,电子转移总数是
23、某温度下,纯水中的[H +]=2.0×10-7mol/L,则纯水中的[OH -]=____________;
若温度不变,滴入稀盐酸使溶液中[H +]=5.0×10-6mol/L,则溶液中的
[OH -]=_______________
24、双氧水(H2O2)和水都是极弱的电解质,但H2O2比H20更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:
_______________________________________________________________
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可以形
成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:
________________________________________________________________
(3)水电离生成H3O+和OH -叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式为 _____________________________________
五、(本题包括2小题,共22分)计算题
25、由NO2和O2组成的混合气体40ml,通过足量的水后剩余气体5ml,则原混合气体中NO2和O2的体积比为多少?
26、在373K时,把0.125molN2O4气体通入体积为500mL的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2含量为0.01mol,进行到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍,则求:
1)开始2s内,以N2O4表示的反应速率为多少?
2)达平衡时,体系的压强是开始时的多少倍?
3)N2O4的平衡时的浓度为多少?