高二化学第一学期期中考试试卷
(化学班用)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至3页,第Ⅱ卷4至7页,共150分。考试用时120分钟。
第Ⅰ卷(选择题 共60分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、学号、考试科目,用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案;不能答在试题卷上。
3.考试结束,将本试卷保存好,把答题卡交上。
可能用到的原子量:H 1.0 Fe 56.0 S 32.0 N 14.0 Cl 35.5 Co 58.9
一.选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意。)
1.下列气体不会造成大气污染的是( )
A.二氧化硫 B.氮气 C.一氧化碳 D.一氧化氮
2.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究
有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖,关于NO的下列叙述不正确的是( )
A. NO是红棕色气体 B. NO可以是某些含高价N物质还原的产物
C. NO不是亚硝酸酐 D. NO可以是某些含低价N物质氧化的产物
3.能源可划分为一级能源和二级能源.自然界中以现成形式提供的能源称为一级能源;需依靠其它能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:
2H2O(液)=2H2(气)+O2(气)-517.6千焦
下列属于一级能源的一组是 ( )
①电能 ②水力
③天然气
④煤炭
A.①②③ B. ②③④ C. ①②④ ![]() D.
①③④
D.
①③④
4.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir〕元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是19177Ir,则其核内的中子数是
A.77 B.286 C.191 D.114
5.将FeCl3溶液加热蒸干之后灼烧,最后得到的固体物质是( )
A.FeCl3 B.Fe(OH)3
C.Fe2O3 D.FeCl3和Fe2O3
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项。只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
6.下列反应中,HNO3既表现氧化性又表现酸性的是( )
A.C+浓HNO3 B. Cu+浓HNO3
C. FeO+HNO3 D. Fe2O3+HNO3
7.下列说法正确的是( )
A. 强电解质的导电能力不一定比弱电解质的导电能力强。
B. 在可逆反应中,增大压强,正、逆反应速率一定同时增大。
C. PH小于7的溶液不一定显酸性。
D.在可逆反应中,增加反应物的浓度,正反应的速率加快而逆反应速率减慢。
8.下列反应达到平衡后,减压或升温都能使化学平衡向逆反应方向移动的是( )
![]() A.S(s)+O2
SO2 (正反应为放热反应)
A.S(s)+O2
SO2 (正反应为放热反应)
![]() B.N2 +3H2
2NH3 (正反应为放热反应)
B.N2 +3H2
2NH3 (正反应为放热反应)
![]() C.C(s)+ CO2 2CO (正反应为吸热反应)
C.C(s)+ CO2 2CO (正反应为吸热反应)
![]() D. H2+I2(g) 2HI (正反应为吸热反应)
D. H2+I2(g) 2HI (正反应为吸热反应)
![]() 9.反应2A(g)+B(g) 2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示。下述判断
9.反应2A(g)+B(g) 2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示。下述判断
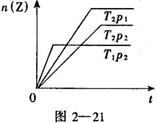 正确的是( )
正确的是( )
A. T1>T2,p1>p2
B.T1<T2,p1>p2
C. T1<T2,p1<p2
D.T1>T2,p1<p2
![]() 10.下列液体pH>7的是( )
10.下列液体pH>7的是( )
A. 胃液 B. 食醋 C. 葡萄汁 D. 人体血液
11.下列属于纯净物的是( )
A.五水硫酸铜晶体 B.氨水
C.漂白粉 D.液氨
![]() 12.4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率
12.4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率![]() (X)(反应物的消耗速率或产物的生成速率)可表示为( )
(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. ![]() (NH3)=0.0060 mol/(L·s)
(NH3)=0.0060 mol/(L·s)
B. ![]() (NO)=0.0040
mol/(L·s)
(NO)=0.0040
mol/(L·s)
C.![]() (O2)=0.0060 mol/(L·s)
(O2)=0.0060 mol/(L·s)
D. ![]() (H2O)=0.36 mol/(L.min)
(H2O)=0.36 mol/(L.min)
13.下图表示外界条件(温度、压强)的变化对下列反应的影响:
![]() L(g)+G(g)
3R(g)(正反应为吸热反应),则图中Y轴是指( )
L(g)+G(g)
3R(g)(正反应为吸热反应),则图中Y轴是指( )
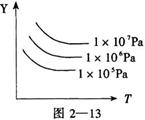
A. 平衡混合气中R的质量分数
B. R的产率
C. 平衡混合气中G的质量分数
![]() D. G的转化率
D. G的转化率
14.下列各组离子,在溶液中不能大量共存的是( )
A.NO3- Fe3+ Cl- H+ B. Na+ OH- NH4+ AlO2-
C. Al3+ NO3- S2- OH- D. K+ OH- Na+ S2-
15.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg 5种金属中的一种.已知:(1)a、c均能与稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱反应放出气体;(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为
(
)
A.Mg
Cu Al Ag Fe
B.Al
Cu Ag Fe Mg
C. Fe
Cu Ag Mg Al
D.Mg Al Cu Fe Ag
高二化学第一学期期中考试试卷
(化学班用)
第Ⅱ卷(非选择题 共90分)
班级________姓名___________学号_________成绩________
三.填空题
16.(共8分,每空2分) ①在氯化铝溶液中加入少量的氢氧化钠溶液,可观察到现象:
____________________________
, ②在氢氧化钠溶液中加入少量的氯化铝溶液,可观察到
现象: ______________________________________________ , 写出①的化学方程式:
__________________________________________________________,写出②的离子方程式
__________________________________________________________.
![]() 17.(共4分,每空2分)1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为:
17.(共4分,每空2分)1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为:
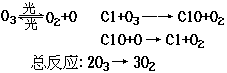
在上述臭氧变成氧气的反应过程中,Cl的作用是:_______________,写出上述
反应的总反应方程式为:_______________________________________________
18.(8分)pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强
碱与强酸的体积比是:______________;若所得混合液的PH=11,则强碱与强酸的体积比是:___________. PH=2的盐酸与 PH=5的盐酸等体积混合后所得溶液的PH为________,PH=8的氢氧化钾溶液与 PH=11的氢氧钾溶液等体积混合后所得溶液的PH为_________.
19.(共10分,每空2分)在一定温度下,把2摩A和1摩B通入一个一定容积的密闭的容器里,发生如下反应:
|
|
当此反应进行到一定程度时,反应混和物就处于化学平衡状态.现在该容器中,维持温度不变,令a、b、c分别代表初始加入的A、B和C的物质的量(摩).如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同.请填写下列空白:
(1)若a=0,b=0,则c= ______.
(2)若a=0.5,则b=_______ 和c=______
.
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c):①__________________.②_____________________
20.(共10分,每2分)下图中的每一个方格表示有关的一种反应物或生成物,其中A,C,D为无色气体.请填下列空白: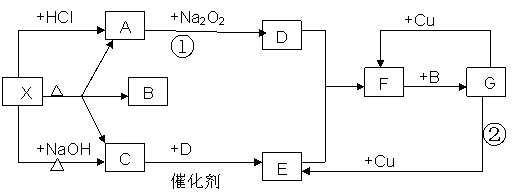

(1)物质X可以是______________________,C
是____________,F是____________.
(2)反应①化学方程式是________________________________________________
(3)反应②的离子方程式是______________________________________________
21.(共8分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4- + 5HSO3- + H+
===2Mn2+ + 5SO42- + 3H2O 填空回答问题:
(1)该滴定实验所需仪器有下列中的______________________________(填序号)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台
F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)滴定前平视KMnO4溶液,刻度为a mL,若滴定后(终点)俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积_________( 多、少)。根据(b-a)mL计算得到的待测液浓度比实际的浓度_________(大、小)。若滴定后(终点)平视液面刻度为c mL,假设被滴定的未知浓度NaHSO3溶液的体积为V mL,请写出求NaHSO3溶液的物质的量浓度的计算式:___________________________________________________________
|
|
|
|
|
|
|
22.(6分)完成配平下列化学方程式并回答问题。
Pt + HNO3
+ HCl = H2PtCl6
+ + NO↑+
其中氧化剂为:______________,电子转移总数为:_______________
23.(6分)PH=2的盐酸,由水电离的c(H+)=a,PH=5的NH4Cl溶液,由水电离的c(H+)=b,
则a______b(填>、< 或 =),请说明你选择的理由是:_____________________________
__________________________________________________________________________.
![]() 24.(5分)近年来,某些自来水公司在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl,NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因:______________________________________________________________
24.(5分)近年来,某些自来水公司在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl,NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因:______________________________________________________________
________________________________________________________________________
25.(共5分)配制硫酸铁溶液常出现浑浊现象,其原因是
________,
如何操作既可得到透明溶液而又不引进杂质离子
____ 。
四.计算题(共20分)
26.(本题8分)某硫酸厂用接触法制硫酸,有关反应①4FeS2+11O2 = 2Fe2O3+8SO2
②2SO2 + O2
= 2SO3 ③ SO3
+ H2O = H2SO4 ,若在①反应中有黄铁矿损失5%,②反应中SO2
的转化率92%,③反应中SO3损失0.6%。现有含FeS2 95%的黄铁矿(杂质中不含硫元素)100t,问可制得98%的浓硫酸多少吨?(本题可能用到的原子量:H 1.0 Fe 56.0 S 32.0 )
27.(本题12分)某化合物的化学式可表示为Co(NH3)xCly(x,y均为正整数)。为确定x和y的值,取两份质量均为0.214克的该化合物进行如下两个实验。实验①:将一份试样溶于水,在硝酸存在的条件下用AgNO3溶液滴定(生成AgCl沉淀),共消耗24.0毫升0.100摩/升的AgNO3溶液。实验②:在另一份试样中加入过量 NaOH溶液并加热,用足量盐酸吸收逸出的NH3。吸收NH3共消耗24.0毫升0.200摩/升HCl溶液。试通过计算确定该化合物的化学式。
(本题可能用到的原子量:H 1.0 N 14.0 Cl 35.5 Co 58.9)
第一学期南海一中期中考试试题参考答案
高二化学(化学班用)
一.二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | B | A | B | D | C | BC | AC | B | A | D | AD | BD | C | BC | A |
三.填空题
16.白色沉淀, 先有白色沉淀生成后溶解; AlCl3+3NaOH=Al(OH)3↓ +3NaCl
Al3+ + 4OH-=AlO2-+2H2O
|
17.催化剂, 2O3=====3O2
18 . 1:10 , 1:9 , 2.3 , 10.7
19.(1) c=2moL (2)b=0.25moL c=1.5moL (3) a+c=2 2b+c=2
20.(1) (NH4)2CO3 或NH4HCO3, NH3 , NO2
(2 ) 2CO2+2Na2O2=2Na2CO3+O2
(3 ) 2NO3- + 8H+ + 3Cu==2NO+3Cu2++4H2O
21.(1) ABDEFGH (2) 少, 小 (3 ) C(NaHSO3)=2.5 x 0.001(c-a)/V moL
22. 3, 4, 18, 3, 4, 8, H2O , HNO3 , 12e- (配平4分,其余每空1分)
23. < , 盐酸电离出H+,抑制水的电离,而NH4+发生水解促进水的电离.( 第一个空2分,第二个空4分)
24. 加入液氨后,液氨与HClO作用生较其稳定的NH2Cl,当HClO起杀菌作用时,平衡向左移动,当不起杀菌作用时, HClO以较其稳定的NH2Cl形式存在.
25. Fe3+发生水解生成Fe(OH)3, 将硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需浓度.
四.计算题
26. FeS2--------------------------------------------------------2H2SO4
120t 196t
100x95%x (1-5%)x 92% x (1-0.6%)t m x 98%
m=137.55t
答:略
27. n(NH3)=0.200x24.0x10-3=4.80x10-3 (moL)
m(NH3)=4.80x10-3x17=8.16x10-2 (g)
n(Cl)=0.100x2.40x10-3=2.40x10-3 (moL)
m(Cl)=2.40x10-3x35.5=8.52x10-2 (g)
m(Co)=0.214-8.16x10-2-8.52x10-2=4.72x10-2 (g)
n(Co)= 4.72x10-2/58.9=8.01x10-4 (moL)
n(Co): n(NH3): n(Cl)=1:6:3
所以该化合物的化学式为Co(NH3)6Cl3
命题人:陈静华 审题人:詹海东