高二化学单元测试
第四章 几种重要的金属
(满分100分,检测时间60~80分钟)
班级 姓名 成绩
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
Al 27 S 32 Cl 35.5 K 39
一、 择题(本题共20个小题,每小题只有一个选项符合题意,1~10题每小题2分,11~20题每小题3分,共50分)
1. 下列固体中,不是黑色的是 ( )
A.Fe3O4 B.Fe2O3 C.FeO D.FeS
2.下列叙述中,正确的是 ( )
A. 含金属元素的离子一定是阳离子
B. 某元素从化合态变为游离态时一定被还原
C. 在氧化还原反应中,非金属单质一定是氧化剂
D. 金属阳离子被还原不一定得到金属单质
3.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A. 避免产生“白色污染”
B. 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C. 不使电池中渗泄的电解液破坏臭氧层
D. 利用电池外壳的金属材料
4.下列各对试剂中,用来制备硫酸亚铁最合适的是 ( )
A.Fe(NO3)2和稀H2SO4 B.Fe(OH)2和稀H2SO4
C.Fe3O4和稀H2SO4 D.Fe和稀H2SO4
5.下列说法不正确的是 ( )
A.在原电池中,活泼金属一般作负极 B.在原电池中,受到腐蚀的总是负极
C.在原电池中,阳离子向负极移动 D.在原电池中,正极发生的是还原反应
6.将一定质量的金属钠投入一定质量一定浓度的AlCl3溶液中充分反应。下列说法中不正确的是( )
A.一定有气体放出 B.不一定有沉淀产生
C.一定得不到澄清溶液 D.可能得到澄清溶液
7.下列各组混合物,不能作铝热剂的是 ( )
A.Al、V2O5 B.Al、MnO2 C.Al、MgO D.Al、Co3O4
8.下列离子方程式中,正确的是 ( )
A.氧化亚铁和稀硝酸反应 FeO+2H+=Fe2++H2O
B.铜和三氯化铁溶液反应 Cu+Fe3+=Fe2++Cu2+
C.氯化亚铁溶液中滴入Cl2 Cl2+2Fe2+=2Cl-+2Fe3+
D.金属铝投入NaOH溶液中 2Al+2OH-+H2O=2AlO2-+2H2↑
9.用两根铁丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池反应为:CH4+2KOH+2O2=K2CO3+3H2O,若该电池中1molCH4参加反应,则转移电子的物质的量为
A.1mol B.2mol C.4mol D.8mol
10.在稀H2SO4中插入一块铜片,加入下列物质后,可使Cu片迅速发生腐蚀的是 ( )
A.稀盐酸 B.FeCl2晶体 C. Na2SO4晶体 D.KNO3晶体
11.某强碱性透明溶液里能大量存在的离子组是 ( )
A. Na+、Cl-、Al3+、Ca2+ B. K+、S2-、HCO3-、NH4+
C. AlO2-、Na+、K+、Cl- D. Fe2+、Na+、NO3-、H+
12.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程为:
2Ag +Zn(OH)2 ![]() Ag2O +
Zn +H2O 。在放电时,正极上发生反应的物质是 ( )
Ag2O +
Zn +H2O 。在放电时,正极上发生反应的物质是 ( )
A.Ag B. Zn C.Ag2O D.Zn(OH)2
13.有200mL MgCl2和AlCl3的混合溶液,其中c (Mg2+)为0.2mol/L,c (Cl-)为1.3mol/L,要使Mg2+全部转化为沉淀从溶液中分离出来,至少需要加4mol/L NaOH溶液的体积为 ( )
A. 40mL B.70mL C.80mL D. 128mL
14.下列反应能获得二价铁盐的是 ( )
①铁粉与硫粉共热 ②铁丝在氯气中燃烧 ③铁丝在氧气中燃烧 ④铁与足量稀HNO3反应 ⑤铁与足量稀H2SO4反应 ⑥氧化亚铁与盐酸反应 ⑦氧化亚铁与稀HNO3反应 ⑧铁与硫酸铜溶液反应
A. ①③⑤ B. ①④⑥⑧ C. ①②③⑤ D. ①⑤⑥⑧
15.将Fe2O3和CuO、Fe粉的混合物投入盐酸中,有固体剩余,则所得溶液 ( )
A.可能含有FeCl3、FeCl2 B.一定含有 FeCl2、CuCl2
C.一定含有FeCl2 D.一定含有FeCl2、 HCl
16.为了确定下列物质是否部分氧化,用一种试剂(括号内)进行实验。其中,所选试剂不合适的是( )
A. K2SO3(BaCl2) B. FeCl2 (KSCN) C. KI (淀粉) D.白磷(石蕊试液)
17.等体积的AlCl3溶液和NaOH溶液混合后,若沉淀中含 Al的质量与溶液中含Al的质量相等,则AlCl3溶液和NaOH溶液的物质的量浓度之比为 ( )
A. 3 : 2 B. 2 : 4 C. 1 : 4 D. 2 : 7
18.取0.8mol/L的金属氯化物MCln的溶液10mL,恰好能使120mL 0.1mol/L Ba(OH)2溶液中的OH-全部沉淀,则该金属的化合价是 ( )
A. +4 B. +3 C. +2 D. +1
19.下列各组溶液中均有两种不同的金属离子,分别加入足量的氨水后,观察到的现象相同的是 ( )
A. Fe3+、Al3+ B. Mg2+、 Al3+ C. Fe2+、 Mg2+ D. Fe2+、 Fe3+
20.将8.4g铁粉和3.2g硫粉均匀混合加热至红热,冷却后加入足量盐酸,在标准状况下收集到的气体是( )
A. 1.12L B. 2.24 L C. 3.36L D. 4.48 L
二、填空题(本题包括5小题,共35分)
21.(8分)用含有少量铁锈的铁屑制取绿矾(FeSO4·7H2O),还需要的化学试剂是 ,制备过程中,写出所有可能发生的反应的化学方程式 、 、
。
22.(8分)将一个用金属铝做的易拉罐内充满CO2后,然后往灌内注入足量的NaOH溶液,立即用胶布封罐口,经过一段时间后,罐壁凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起来。
(1)罐壁凹而瘪的原因是 ,
反应的化学方程式为 。
(2)瘪了的罐壁重新鼓起来的原因是 ,
反应的化学方程式为 。
23.(9分)从铝土矿(含杂质Fe2O3和SiO2)中提取Al2O3的过程如下:①铝土矿粉碎、过筛后用烧碱液浸提;②过滤,将滤液用盐酸酸化,此时铝以Al3+形式存在,同时析出胶状沉淀;③过滤,在滤液中加NH3·H2O又析出沉淀;④过滤,灼烧沉淀,得Al2O3 。
(1)写出步骤①中发生反应的离子方程式 。
(2)步骤②得到胶状沉淀的化学式是 。
(3)步骤③、④发生反应的化学方程式 、 。
24.(4分)将相同质量的镁条分别在①氧气 ②氮气 ③空气 ④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的排列顺序为 。
25.(6分)用含:①Fe3+ ;②I- ;③I2 ;④H2S的四种溶液进行下面的实验:
(1)将②和③溶液混合后再加入①溶液,反应后溶液有Fe3+,则溶液中还存在 离子,不存在 离子。
(2)将②和③溶液混合,再加入④溶液,反应后溶液中没有I2 ,则溶液中肯定有 离子,可能有
离子。
(3)取①溶液和④溶液混合,反应的离子方程式为 。
三、计算题(本题包括2小题,共15分)
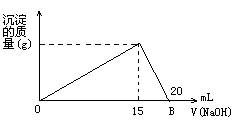 26.(7分)向20mL某浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如右图所示。
26.(7分)向20mL某浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如右图所示。
(1) 图中A点表示的意义是
(2)最大沉淀量为 g
(3)所用AlCl3溶液的物质的量浓度是
(4)当所得沉淀量为0.39g时,用去NaOH溶液的体积是 mL 或 mL.
27.(8分)取铁粉和氧化铁粉的混合物样品14.88g,加入125mL稀硫酸充分反应,当固体粉末完全溶解时,收集到气体3.36L(标准状况)。当向溶液中滴加KSCN溶液时,溶液不显红色。再用5mol/L的NaOH溶液中和过量的硫酸,当NaOH溶液加至150mL时,恰好把溶液中的金属阳离子全部沉淀。求:
(1) 原样品中氧化铁的质量分数。
(2) 稀硫酸的物质的量浓度。
答案:
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | D | B | D | C | C | C | C | D | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | C | C | D | C | A | D | B | B | C |
二、填空题
21.稀硫酸 ;Fe + H2SO4 = Fe SO4 , Fe2O3 + 3 H2SO4 == Fe2(SO4)3 + 3H2O , Fe + Fe2(SO4)3 =3 FeSO4
22.(1)CO2被NaOH吸收,使罐内压强减小;CO2 + 2OH- = CO32- + H2O
(2)Al与NaOH反应产生H2,使罐内压强重新增大 。2Al +2OH- + 2H2O = 2AlO2- + 3H2↑
23.(1)Al2O3 + 2OH- = 2AlO2- + H2O ,SiO2 + 2 OH- = SiO32- + H2O
(2)H2SiO3 (3) Al3+ + 3NH3·H2O
= Al(OH)3↓ + 3NH4+
2Al(OH)3 ![]() Al2O3
Al2O3
24. ④①③②
25. (1)Fe2+ ; I- (2) H+,I- ; S2-, HS- (3)2Fe3+ +H2S = 2H+ +2Fe2+ + S↓
26. (1)Al3+全部沉淀 (2)0.78g (3) 0.5mol/L (4) 7.5mL ,17.5mL
27. (1)32.25% , (2)3mol/L