高二化学单元检测题A
《1――4章综合》(A)
(满分100分,检测时间90分钟
班级 姓名 成绩
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5
一、选择题(本题共22个小题,每小题只有一个选项符合题意,每小题2分,共44分)
1. 下列物质会对臭氧层造成严重破坏的是
A.一氧化碳 B.氮氧化物(如NO、NO2等)
C.二氧化碳 D.二氧化硫
2. 将FeCl3溶液加热蒸干,所得的固体物质主要是
A.Fe2O3 B. FeO C. Fe(OH)2 D. Fe(OH)3
3.下列各组气体,在通常情况下能够稳定共存的是
A.NH3、O2、HCl B.N2、H2、HCl
C. CO2、NO、O2 D.H2S、O2、SO2
4. 下列说法违反科学原理的是
A. 化银可用于人工降雨
B. 电时空气中的N2可变为氮的化合物
C.添加少量某物质可将水变成燃料油
D.在一定温度、压强下石墨可变成金刚石
5.
在CO(g)+H2O![]() CO2(g)+H2(g)(正反应为放热反应)反应中,改变下列条件,不能使V(正)增大的是
CO2(g)+H2(g)(正反应为放热反应)反应中,改变下列条件,不能使V(正)增大的是
A.升高温度 B.使用催化剂 C.减小压强 D.缩小容器体积
6.
已知反应A+3B![]() 2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L·min)则此时段内以C的浓度变化表示的化学反应速度为
2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L·min)则此时段内以C的浓度变化表示的化学反应速度为
A. 0·5mol/(L·min) B.1mol/(L·min) C.2mol/(L·min) D.3mol/(L·min)
7.
在一定温度下,反应A2(g)+B2(g) ![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A. 容器内气体的总压强不随时间变化而变化
B. 单位时间内生成n mol A2,同时生成n mol B2
C. 单位时间内生成n molA2,同时生成2n mol AB
D.单位时间内有n mol B2发生反应,同时有n mol AB分解
8. 总压强为3.0×107pa时,氮氢混合气体(体积比为1︰3)通入合成塔,反应达到平衡时,压强降为2.5×107pa,则平衡时混合气体中氨的体积分数为
A.35% B.30% C.25% D.20%
9.足量的镁粉与一定量的盐酸反应时反应速率太快,若要减缓反应速率,又不能影响产生氢气的总质量,可加入的物质是
A.CaO B.NaOH C.KHCO3 D.CH3COONa
10.下列事实中证明氨水是弱碱的是
A.铵盐受热易分解
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.0.1mol·L-1氨水可以使酚酞溶液变红
D.0.1mol·L-1氯化铵溶液的pH约为5
11.纯水在10○C和50○C的PH,前者与后者的关系是
A.前者大 B.前者小 C.相等 D.不能确定
12下列各式中属于盐类的水解且离子方程式正确的是
A.
Fe3++H2O![]() Fe(OH)3↓+3H+ B.CO32-+H20
Fe(OH)3↓+3H+ B.CO32-+H20![]() H2CO3+2OH-
H2CO3+2OH-
C.CH3COOH+H2O![]() CH3COO-+H3O+ D.NH4++H2O
CH3COO-+H3O+ D.NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
13在0.1mol·L-1硫酸铵溶液中,下列关系正确的是
A. 2c(SO42-)= c(NH4+)>c(H+)=c(OH-)
B. c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C. c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. c(NH4+)>c(SO42-)>c(OH-)>c(NH3·H2O)
14.四种锌的合金各50g,分别投入足量盐酸中,都产生氢气22.4L(标准状况),则各合金中锌的质量分数最多的是
A.钠锌合金 B.镁锌合金 C.铝锌合金 D.铁锌合金
15.下列仪器中,没有“0”刻度线的是
A.温度计 B.量筒 C.酸式滴定管 D.托盘天平游码刻度尺
16.在四支干燥的试管里分别充满CO2、O2、NO2、NH3四种气体,将试管倒插入水槽里,轻轻掁荡,最终水上升到试管内的高度从低到高的顺序是
A.CO2、O2、NO2、NH3 B.O2、CO2、NO2、NH3
C. CO2、NO2、O2、NH3 D.CO2、NH3、O2、NO2
17.浅绿色的Fe(NO3 )2溶液中存在如下平衡:Fe2++H2O![]() Fe(OH)2+2H+,若向溶液中滴加足量盐酸,则溶液的颜色
Fe(OH)2+2H+,若向溶液中滴加足量盐酸,则溶液的颜色
A.变黄 B.绿色更深 C.绿色变浅 D.无变化
18.在酸性溶液中,可以大量共存的离子组是
A.Na+、Fe2+、Cl-、NO3- B.K+、S2-、SO42-、Na+
C.K+、NH4+、NO3-、OH- D.SO42-、NH4+、NO3-、Fe3+
19.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:2OH-+H2-2e-=2H2O和1/2O2+H2O+2e-=2OH-,则下列叙述正确的是
A. 通入H2的一极是正极,通入O2的一极是负极
B. 通入O2的一极是正极,通入H2的一极是负极
C. 工作一段时间后电解质溶液的pH增大
D.工作时负极区附近的pH增大
20.在室温下,等体积的下列酸和碱的溶液混合后pH一定小于7的是
A. pH=3的硝酸与pH=11的氢氧化钾
B. Ph=3的盐酸与pH=11的氨水
C. PH=3的硫酸与pH=11的氢氧化钠溶液
D.PH=3的醋酸与PH=11的氢氧化钡溶液
21.现有下列物质:①氯水 ②氨水 ③浓硝酸 ④氢氧化钠 ⑤溴,其中必须保存在棕色瓶中的是 ( )
A.全部 B. ①③⑤ C.①③ D.①②④
22.将a mol钠和a mol铝同时投入到m g足量的水,所得溶液密度为d g/mL,该溶液中溶质的质量分数为 ( )
A.
![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
二、填空题(本题包括5小题,共36分)
23.(6分)完成下列化学方程式,将化学计量数和未知物的化学式填在方格内;
Cu2S + HNO3 = Cu(NO3)2 + NO↑ + H2SO4 + .
(1)此反应中氧化剂是(填写化学式) ,被氧化的元素是 。
(2)若有22.4L(标准状况下)NO产生,则转移的电子数目为 。
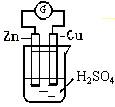 24.(6分)某学生进行如右图所示的锌-铜原电池实验:
24.(6分)某学生进行如右图所示的锌-铜原电池实验:
(1)从理论上分析,预期看到的现象是
(2)实验过程中观察到锌极上有少量气泡逸出,铜极上有大量气泡逸出,试解释: 。
(3)在实验室里用锌粒与稀硫酸反应制H2的过程中,若发现产生H2速率较慢,可向其中加入几滴 溶液。
(4)实验过程中,电流计指针偏向 极。
25.(12分)某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
①在250mL的容量瓶中配成250mL烧碱溶液
②用碱式滴定管量取25mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
③在天平上准确称取烧碱样品m g,要烧杯中用蒸馏水溶解
④将物质的量浓度为c mol/L的标准硫酸溶液装入酸式滴定管,调节液面,开始读数为V1 mL
⑤在锥形瓶下垫一张白纸,滴定溶液呈橙色为止,记下读数为V2 mL
填空:
(1)正确的操作顺序是 (填序号)
(2)观察滴定管里液面的高度时应注意 。
(3)在操作步骤⑤中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时,将锥形瓶用烧碱溶液洗涤,使测定的浓度 (填“偏高”或“偏低”),原因是 。
(5)该烧碱样品纯度的计算式为 。
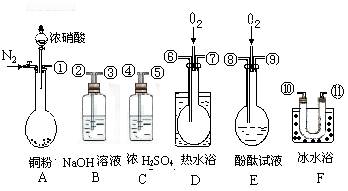 26.(7分)用下图所示的仪器、药品验证由铜和适量的浓硝酸反应产生的气体中有NO(仪器可选择使用,N2和O2的用量可自由控制)。已知:①NO+NO2+2OH-→2NO2-+H2O;②气体液化温度:NO2为21℃,NO为-152℃
26.(7分)用下图所示的仪器、药品验证由铜和适量的浓硝酸反应产生的气体中有NO(仪器可选择使用,N2和O2的用量可自由控制)。已知:①NO+NO2+2OH-→2NO2-+H2O;②气体液化温度:NO2为21℃,NO为-152℃
完成:
(1)现有甲、乙、丙三位同学分别
设计了以下三个实验方案(用仪器
的连接顺序表示)。
甲:A→C→F→D→B
乙:A→B→C→E
丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓硝酸反应产生的气体中含有NO?
甲 ;乙 ;丙 (填“能”或“不能”)。具体说明不能验证的主要原因(若你认为三个实验方案都能验证,则此小题不用回答)
。
(2)反应前应先通入足量的N2,其目的是 。
(3)确认气体中含有NO的现象是 。
27.(5分)某待测溶液中可能含Fe2+、Fe3+、Al3+、Ag+、Ba2+、Ca2+、NH4+等离子,进行了如图所示的实验(所加酸、碱、氨水、溴水、CO2都是过量的)。
![]()
![]() 溶液C
溶液C
![]()
![]()
![]()
![]()
![]() 稀H2SO4 溶液B 氨水 NaOH 沉淀D
稀H2SO4 溶液B 氨水 NaOH 沉淀D
![]()
![]()
![]()
![]()
![]() 稀HCl 溶液A 沉淀C
稀HCl 溶液A 沉淀C
![]()
![]()
![]()
![]() 待测溶液 溴水 沉淀B 溶液DCO2 沉淀E
待测溶液 溴水 沉淀B 溶液DCO2 沉淀E
![]() 沉淀A
沉淀A
不溶于稀HNO3
根据实验结果,回答以下问题。
(1)待测溶液中有无Ba2+和Ca2+离子,并写出理由,答: 。
(2)沉淀D的化学式为 。
(3)写出溶液D生成沉淀E的离子方程式 。
三、计算题(本题包括2小题,共14分)
28.(6分)标准状况下,欲用一定量的水吸收氨气来制得浓度为12.0mol·L-1、密度为0.915g·cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的相对分子质量以17.0计,水的密度以1.00g·cm-3计)
29.(8分)把9g镁铝合金投入40mL氢氧化钠溶液中,测得反应产生的气体的体积为3.36L(标准状况),加入足量盐酸后,残存的金属全部溶解,测得反应又产生6.72L气体(标准状况)。试计算:
(1) 合金中铝的质量分数。
(2) 原氢氧化钠溶液的物质的量浓度。
答案
一、1.B 2. A 3. B 4.C 5.C 6.C 7.C 8.D 9.D 10.D 11.A 12.D 13.C 14.C 15.B 16.B 17.A 18.D 19.B 20.D 21.B 22.C
二、23. 3,22; 6,10,3,8H2O
(1) HNO3;Cu , S (2)1.806×1023
24. (1)铜板上产生大量气泡
(2) 铜板上有大量气泡是因为锌与铜形成原电池,而锌上有少量气泡逸出是因为锌板含有杂质如铁、铜、铅等,在其表面上形成小型原电池。
(3) 硫酸铜
(4) 铜板(或正极)
25、(1)③①②④⑤ (2)视线与凹液面一致
(3) 易于观察指示剂颜色变化
(4) 偏高,因为锥形瓶中的烧碱量增加,使计算出的浓度变大。
(5) 0.8c(V2—V1)/ m
26. (1) 甲:能; 乙:不能 ,因为NaOH溶液可能将其吸收完全了;丙:不能,因为产物中的NO2与H2O反应产生NO,就会干扰对原产物中NO的检验。
(2)排尽装置中的空气
(3)无色气体变为红棕色
27.(1)不能确定,但可肯定有Ca2+或Ba2+中的一种;因为BaSO4难溶,CaSO4微溶
(2)Fe(OH)3
(3) AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
三、
28.V=378L
29. (1) 60% (2) 2.5mol/L