高二化学氮族 镁铝
一、选择题(每小题有1~2个正确答案)
1、标况下nLNH3溶于水中得到密度为![]() 的氨水AL,则此氨水的质量分数为
的氨水AL,则此氨水的质量分数为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
2、室温,将NO和O2以体积比3:1混合,则混合气体平均式量最接近
A. 40.7 B. 46 C. 30.5 D. 61
3、现有100毫升3摩/升的NaOH溶液和100毫升1摩/升的氯化铝溶液.⑴将NaOH溶液分多次加到氯化铝溶液中;⑵将氯化铝溶液分多次加到NaOH溶液中.比较两种操作的结果是
A.现象相同,沉淀量不等 B.现象相同,沉淀量也相等
C.现象不同,沉淀量相等 D.现象不同,沉淀量不等
4、将下列试剂加入或通入到偏铝酸钠溶液中最终可析出沉淀的是
A.盐酸(过量) B.二氧化碳 C.浓氨水 D.氯化铝溶液
5、化合物M溶于水加少量AgNO3溶液有白色沉淀,如果先在M的水溶液中加入一定量的NaOH溶液,再加少量AgNO3溶液,则无沉淀生成,M可能是 A. NaCl B. CaCl2 C. MgCl2 D. NH4Cl
6、将0.1mol·L-11mL H3PO4溶液与13mL 0.02mol·L-1 KOH溶液混合后,能表示此反应的是
A. ![]() B.
B. ![]()
C. ![]()
D. ![]()
7、向三份V体积![]() 溶液中分别加入
溶液中分别加入![]() 的H3PO4溶液,反应后分别生成
的H3PO4溶液,反应后分别生成![]() 、
、![]() 、
、![]() 所需H3PO4溶液的体积比为
所需H3PO4溶液的体积比为
A. 1:2:3 B. 3:2:1 C. 2:3:6 D. 6:3:2
8、384mg铜跟适量的浓HNO3反应,铜全部作用后,共收集到气体224mL(标况),反应消耗的HNO3的物质的量可能是 A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
9、可在实验室制取氨气的方法是
A. 在浓氨水中加固体NaOH并加热 B. NH4Cl溶液和NaOH溶液混合
C. 加热分解NH4Cl晶体 D. 加热消石灰和NH4Cl固体混合物
10、把aL含(NH4)2SO4和NH4NO3的混合液分成2等份,一份用bmolNaOH刚好把NH3全部赶出,加一份与BaCl2溶液完全反应,消耗c mol BaCl2则原溶液中[NO3-]为(mol·L-1)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
11、向含3mol Ca(OH)2的石灰水中逐滴加入H3PO4溶液至不再发生反应为止,所得盐的物质的量(纵坐标y)与加入H3PO4物质的量(横坐标x)的关系图是
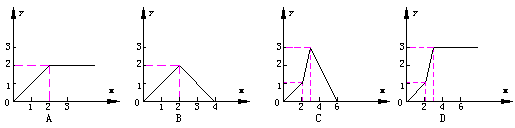 |
12、将充满NO2和O2的量筒倒立于盛有水的水槽中,经过一段时间后,水上升到量筒体积的一半处停止了,则剩余气体的成份是 A. NO2 B. NO C. O2 D. NO或O2
13、2.3克钠投入100毫升硫酸铝溶液中,Al3+全部变为AlO2-,再滴入一滴盐酸立即产生白色沉淀,则硫酸铝溶液的物质的量的浓度是 A.0.5摩/升 B.0.125摩/升 C.0.25摩/升 D.0.1摩/升
14、将m克钠和铝的混和物放入n克水中,待反应停止后,得到a克沉淀,则滤液中的溶质是 A.NaAlO2 B.NaAlO2和NaOH C.Al(OH)3 D.NaOH
15、向含有a摩AlCl3溶液中加入含有b摩KOH溶液,生成沉淀的物质的量可能是 ①a摩 ②b摩 ③a/3摩 ④b/3摩 ⑤0摩 ⑥(4a-b)摩 A、①③④⑤⑥ B、①②③④⑤ C、①④⑤⑥ D、①④⑤
16、已知NaHS、MgSO4、NaHSO3组成的混和物中,硫元素的质量分数为a%,则混和物中氧元素的质量分数为 A、a% B、2a% C、1-0.0175a D、1-0.0075a
17、将充有m mol NO和n mol NO2气体的试管倒立于水槽中,然后通入m mol O2,若已知n>m,则充分反应后,试管中的气体在同温同压下的体积为
A. (4n-1)/2 B. (n-m)/3 C. (3m+n)/3 D. 3(n-m)
18、镁条在二氧化碳中剧烈燃烧,瓶壁有黑点和白色粉末,不能说明〖〗
A.二氧化碳显示氧化性
B.二氧化碳是酸酐 C.二氧化碳中含有碳元素 D.助燃与不助燃是相对的
19、常温下,A、B两种气体组成的混合气体(MA>MB),经分析混合气体中只含氮氢两种元素,而且不论A和B以何种比例混合,N和H质量比总大于14/3,下列组合中符合这种条件的是
A. ![]() 、
、![]() B.
B. ![]() 、
、![]() C.
C. ![]() 、
、![]() D.
D. ![]() 、
、![]()
二、填空
1、雷雨中含微量的HNO3,用化学方程式解释HNO3的形成过程___________、 ________、 _____________
2、把3体积的NO2气体依次通过下列三个分别盛有①NaHCO3饱和溶液。②浓H2SO4③Na2O2的装置后,用排水法把残留气体收集到集气瓶中,集气瓶中气体应是 _____,体积为 _____(同温同压测定)
3、有A、B、C三种气体,A无色,在一定条件下A能与O2反应生成B,B不溶于水它也能与氧气反应生成C,A、C气体皆易溶于水,它们的水溶液酸碱性正好相反,则A、B、C分别为 _____、 _____、 _____。
4、常温下有一种混合气体,可能由He、H2、O2、N2、NH3、NO、HCl、CO2等气体中的几种所组成,取200mL混合气体进行如下实验:①将混合气体通过浓H2SO4体积减少40mL②余下气体通过Na2O2固体容器中充分反应后,体积又减少40mL③将②剩余气体引燃后,再冷却到室温,气体体积减少105mL④最后的剩余气体中有5mL是O2⑤整个反应过程中气体颜色无变化。试回答(1)混合气体一定有哪些气体?各占多少mL? __________(2)混合气体中一定没有哪些气体 ______(3)混合气体中可能有哪些气体 _______________。
5、NO2与NH3在一定条件下充分反应得到非常稳定的产物,其化学方程式为_____________。若20mL混合气体在一定条件下反应,(按上述反应进行),已知实际参加反应的NO2比NH3少2mL,则原混合气体中NO2和NH3的物质的量之比为 ______或 _______。
三、计算
1、一块铜片投入一浓HNO3的试管中,充分反应后铜片有剩余,若将反应产生的气体用隔绝空气的方法收集,可得67.2mL(不计水蒸气)测得此气体对H2的相对密度为28,若将此气体与33.6mLO2混合后通入水中,经过足够长的时间后,水刚好充满整个容器,求此实验中铜片减轻了多少克?有多少克HNO3被还原?(气体体积均在标况下测得)
2、在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,则:
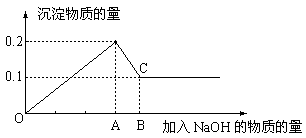
(1)图中C点表示当加入 摩尔NaOH时,Al3+已经 ,Mg2+已经
(2)图中线段OA:AB=
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| B | A | C | B D | D | D | C | C | AD | B | D | C | B |
| 14 | 15 | 16 | 17 | 18 | 19 | |||||||
| A | A | C | B | B | D |
二、1、![]()
![]()
![]()
2、O2,0.25体积 3、NH3、NO、NO2 4、40mL NH3、80mL CO2、70mL H2,HCl、NO、O2,He或N2或He和N2
5、![]() 3:2或3:7
3:2或3:7
三、1、0.192g和0.252g 2、0.6、全部转化成偏铝酸根离子、全部转化成氢氧化镁、5:1