高二化学第二学期期未考试
化 学 试 题
命题:詹海东
第Ⅰ卷(共46分)
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。
注意事项:
1.答第I卷前,考生务必将自己的姓名、考生号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦
干净后,再选涂其它答案,不能答在试题卷上。 ’:
3.考试结束,监考人员将第II卷和答题卡一并收回。
可能用到原子量:H:1 C:12 O:16 N:14 Na:23 S:32 Cu:64 Cl:35.5
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意。)
1.下列各组物质的相互关系不正确的是
A.同位素:H、D、T
B.同素异形体:C(石墨)、C60、C70
C.同系物:分子式为CnH2n+2的一切物质
D.同分异构体:[Cr(H2O)5C1]Cl2·H2O和[Cr(H2O)4C12]Cl·2H2O
2.科学家把不同的原子核称为“核素”。最近,中国科学院兰州近代物理研究所合成新核素
|
|
A.它是一种新元素 B.其原子核内有135个中子
C.它是元素钆(Gd)的一种新的同位素 D.它的相对原子质量为135
3、下列物质属于混合物的是
A、CuSO4·5H2O B、硫酸 C、盐酸 D、干冰
4、氨水和氯水中的离子的种类,前者和后者的关系是:
A、大于 B、小于 C、等于 D、不能确定
5、下列说法正确的是:
A、由于含K+的物质均易溶于水,所以离子方程式中不能出现K+
B、酸碱中和反应的离子方程式都可表示为:H+ +OH- =H2O
![]() C、离子方程式两边的元素种类、原子个数、电荷数都相等时,该方程式一定正确
C、离子方程式两边的元素种类、原子个数、电荷数都相等时,该方程式一定正确
D、溶液中进行的反应:FeCl3 +3KSCN Fe(SCN)3 +3KCl达到平衡时,加入少量KCl晶
体,平衡不移动
6、标准状况下某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在标准状况下所占
的体积(L)应是(NA表示阿佛加德罗常数):
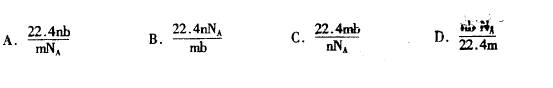
二、选择题(本题包括7小题,每小题4分,共28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
7、在下列溶液中持续通人CO2,产生不溶物且不会消失的是:
A、饱和NaCl溶液 B、Ca(OH)2溶液
C、CaCl2溶液 D、饱和Na2CO3溶液
8.在[HCO3-]=0.1mol·L-1的溶液中,可以大量共存的离子组是
A. Al3+、NO3-、NH4+、C1- B.Na+、SO42-、K+、CH3COO-
C. H+、Ba2+、Cl-、NO3- D. C1-、CO32-、Na+、OH-
9.NA表示阿伏加德罗常数,以下说法中不正确的是
A.通常状态下,金属镁跟稀盐酸反应生成1 molH2,转移电子数为2NA
B.在标准状况下,含m molHCl的浓盐酸与足量的MnO2反应可生成mNA/4个氯气分子
C.在常温常压下,m mol的HT含有的核外电子数为4m NA
D.在标准状况下,22.4L以任意比混合的H2S与SO2混合气体中所含气体分子数必小于NA
10、我国的稀土矿含量丰富,稀土元素可用RE表示。在提纯过程中可以向稀土元素的硫酸盐溶
液中加入粉状Na2SO4,使稀土元素转化为沉淀,反应为:
RE2(SO4)3 +Na2SO4 +xH2O==RE2(SO4)3•Na2SO4•xH2O(x=1,2)
下列有关叙述正确的是
A.该反应一定在强碱溶液中进行
B.产生沉淀的反应为复分解反应
C.反应生成的沉淀属于复盐
D.产生沉淀的变化属于化学变化
11、下列叙述正确的是:
A、含金属元素的离子不一定是阳离子
B、在氧化一还原反应中,非金属单质一定是氧化剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
12、下列为某些卤素或卤化物所特有的性质的是:
A、氢氟酸可用于雕刻玻璃
B、溴化银光照分解
C、淀粉遇单质碘变蓝色
D、单质溴在水和汽油中的溶解度不同
13、在石墨晶体中,每一层由无数个正六边形构成,同一层内每个碳原子与相邻的三个碳原子以
C—C键相结合。则石墨晶体中碳原子数与C—C键数之比为
A、1∶1 B、2∶1 C、3∶2 D、2∶3
高二第二学期期未考试
化 学 试 题
第II卷(非选择题 共104分)
高二(7)班 姓名_____________学号_______________
三、填空题(本题包括5小题,共44分)
14、(6分)过氧化钠属于____________氧化物,其电子式为______________________。把Na2O2放入品红溶液中,观察到的现象是_________________________,说明Na2O2由于强____________性而具有漂白性。完成下列化学方程式:
(1) Na2O2+ H2O=
(2) Na2O2+ SO2=
15、(10分)已知氮化钠(Na3N)在熔融时能导电,与水作用时有NH3产生。试回答下列问题:
(1)写出Na3N的电子式_______________________,氮化钠属于______________晶体。
(2)比较微粒的半径:Na+ _________N3-(填“>”、“<”、“=”)
(3)Na3N与水反应的方程式是________________________________________________,
该反应属于______________反应。
16、(9分)已知X和Y是短周期元素中的同族单质,W、V是化合物,它们有如下反应(式中系数及反应条件均略去):X+W→Y+V,试写出符合上述题意并满足下列要求的化学方程式:
(1)W是水__________________________________________________________________
(2)V是水___________________________________________________________________
(3)W、V均是氧化物_________________________________________________________。
17、(9分)长期以来人们一直认为氟的含氧酸不存在。自1971年科学家将F2通过细冰未水来获得HFO(次氟酸)以来,对HFO的研究引起了充分重视。
(1)写出HFO的结构式,并在元素符号上分别标出化合价:______________________________
(2)HFO与水反应得到A、B两种溶质的溶液,A常用于雕刻玻璃,则HFO与水反应的化学方程式为:
________________________________________________________________________
(3)将B溶液滴入酸性KMnO4溶液中,溶液紫色逐渐褪去,写出反应的离子方程式:
_______________________________________________________________________
18、(10分)在下列物质中选择反应物:Cl2 、CuSO4 、Fe 、Fe(NO3)2 、FeCl3 、HCl 、KI。
按下列要求写出相应的离子反应方程式:
(1) 一种单质氧化一种阴离子:________________________________________
(2) 一种阳离子氧化一种阴离子:______________________________________
(3) 一种单质氧化一种阳离子:________________________________________
(4) 一种单质还原一种阳离子并生成新的阳离子:_______________________________
(5)一种阴离子氧化一种阳离子:_____________________________________________。
四、实验填空题(本题包括3小题,共42分)
19、(12分)某学生为测定氯化铵和硫酸铵混合物中氯化铵的含量,按下图所示实验步骤进行实验
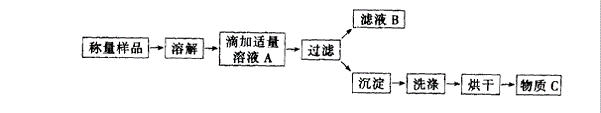
简答下列问题:
(1)溶液A中溶质的化学式______________,物质C的化学式是_______________。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码16g,游码为0.4g,则右盘样品实际质量是_______________________g。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是________________________________。
(4)证明A溶液滴加适量的操作方法是__________________________________________
________________________________________________。
(5)若物质C的质量为23.3g,则原混合物中NH4Cl的质量分数为________________________。
20、(14分)下图是一套制取氯气并以氯气为原料进行特定反应的装置
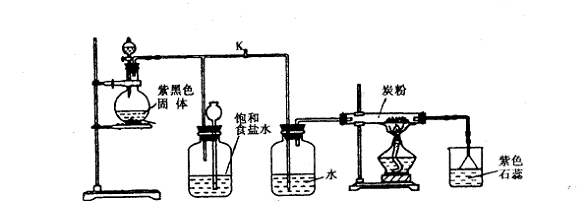
请回答以下问题:
(1) 写出本实验中产生氯气的化学方程式:___________________________________
(2)实验开始时,先打开A处分液漏斗的旋塞,再打开旋塞K,让Cl2充满整个装置,最后点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D,发生氧化还原反应,其产 物为CO2和HCl,试写出D中反应的总化学方程式:
_______________________________________________________________________
装置C的作用为:________________________________________________________
(3) 在E处,紫色石蕊试液由紫色变为红色,再变为无色,其原因是:_______________________________________________________________________________
(4) 将E中溶液改为澄清石灰水,反应过程中现象为下列选项中的:_____________
(A)无明显现象 (B)有白色沉淀生成 (C)先生成白色沉淀继而消失
(5) D处反应完毕后关闭旋塞K,若A处继续有气体产生,此时B中的现象是____________
_________________,B的作用是_______________________________________。
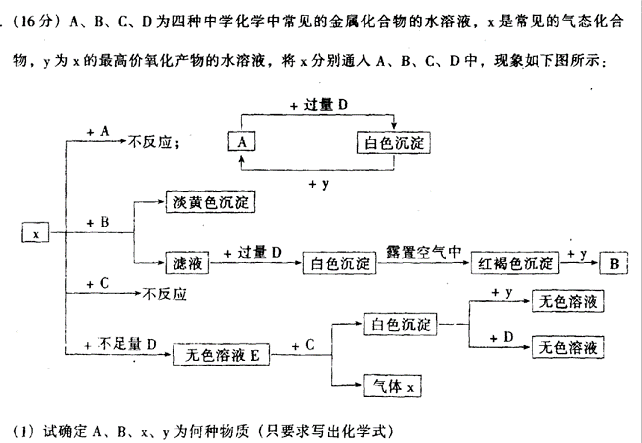
A:______________ B:________________ x:_______________ y:_______________
(2)写出下列反应的离子方程式:
① ① E + C: _____________________________________________________________
② ② x + B: ____________________________________________________________
五、计算题(本题包括2小题,共18分)
22、(8分)把一定量的FeS放入100mL2.0mol•L-1的盐酸中,以制备H2S。FeS完全溶解后,共收集到1.10LH2S气体(标准状况),溶液中H2S的浓度为0.010mol•L-1,假定溶液的体积不变,试计算反应生成H2S的物质的量为_______________________,反应后溶液中Fe2+的物质的量浓度为__________________,反应后溶液中剩余HCl的物质的量为_______________________,反应后溶液中H+的物质的量浓度为________________________。
23、(10分)在250C时,将x molH2S和y molSO2通入一个密闭容器中,使其充分反应。
(1) 此反应的化学方程式为________________________________________________,在此反应中,H2S被氧化的产物(氧化产物)是_____________,SO2被还原的产物是______________。
(2) 要使反应后容器中气体的密度最小,则x与y之比为____________________。
(3) 若x<2y,则反应生成的S的质量为___________________g。
(4) 若x=3y,计算出氧化产物与还原产物的质量之差是________________g
[参考答案]
选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| C | C | C | B | D | A | D | B | BC | CD | AD | AC | D |
14、不成盐;略;品红溶液褪色;氧化。
(1)2、2、4NaOH+O2 (2)Na2SO4
15、(1)略,离子。(2)< (3)Na3N+3H2O=3NaOH+NH3 水解。
16、(1)2Na+2H2O=2NaOH+H2
(2)O2+2H2S=2H2O+S
(3)SiO2+2C=Si+2CO
17、(1) H-O-F 化合价:+1、0、-1
(2)HFO+H2O=HF+H2O2
(3)5H2O2+2MnO4-+6H+=2Mn2++8H2O+5H2O
18、略
19、(1)BaCl2 ,BaSO4(2)15.6(3)玻璃棒(4)取上层清液,加入BaCl2溶液无沉淀。(5)15.38%
20、(1)略 (2)2Cl2+C+2H2O=4HCl+CO2 提供反应物Cl2和水
(3)氯化氢使试液变红,过量的氯气使红色褪去。
(4)A (5)液面上升,安全装置。
21、(1)MgSO4 Fe2(SO4)3 H2S H2SO4
(2)3HS-+Al3++3H2O=Al(OH)3+3H2S
2Fe3++H2S=2Fe2++S+H+
22、0.050mol 0.50mol/L 0.10mol 1.0mol
23、(1)2H2S+SO2=3S+2H2O S S
(2) 2:1 (3)48x (4)32y