高二化学第三章单元测试(理科)
班级 姓名 座号 分数
原子量:H:1 S:32 O:16 Cl:35.5 Na:23 K:39 Fe:56 Ba:137
一、单项选择题
1、 下列叙述中正确的是
A.物质的溶解过程,实质上就是其电离过程
B.二氧化硫的水溶液能导电,所以二氧化硫是电解质
C.1 L 0.1 mol·L-1的H2SO4溶液中含有0.2 mol的H+
D.1 L 0.2 mol·L-1的H2SO3溶液中含有0.2 mol的H+
2、 下列电离方程式中,错误的是
![]() A.Al2(SO4)3===2Al3++3SO42- B.HF H++F-
A.Al2(SO4)3===2Al3++3SO42- B.HF H++F-
![]() C.HI H++I-
D.Ca(OH)2溶液中:Ca(OH)2 ==Ca2++2OH-
C.HI H++I-
D.Ca(OH)2溶液中:Ca(OH)2 ==Ca2++2OH-
3、 下列液体pH>7的是
A.人体血液 B.蔗糖溶液 C.橙汁 D.胃液
4、 用蒸馏水稀释1 mol·L-1醋酸时,始终保持增大趋势的是
A.溶液中的c(CH3COO-) B.溶液中的c(H+).
C.溶液中的c(CH3COOH). D.溶液中的c(OH-)
5、 在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是
A.c(Na+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) B.c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C.c(Na+)﹥c(CH3COO-)﹥c(H+)﹥c(OH-) D.c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
6、将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得c(SO42—)=
0.105mol·L-1、c(Al3+)=0.055mol·L-1,溶液的pH=2.0(假设溶液中硫酸完全电离
为H+和SO42—),则c(K+)为
A.0.045mol·L-1 B.0.035mol·L-1 C.0.055mol·L-1 D.0.040mol·L-1
7、在FeCl3和Fe2(SO4)3的混合溶液中,若不计Fe3+的水解,当溶液中c(Fe3+)=
c(SO![]() )
)
时,下列判断正确的是
A.c(Fe3+)>c(Cl-)
B.c(SO![]() )>c(Cl-)
)>c(Cl-)
C.c(SO![]() )<c(Cl-)
D.FeCl3和Fe2(SO4)3的物质的量相等
)<c(Cl-)
D.FeCl3和Fe2(SO4)3的物质的量相等
8、95℃时,水中的H+的物质的量浓度为10-6 mol·L-1,若把0.01 mol的NaOH固体溶
解于95℃水中配成1 L溶液,则溶液的pH为
A.4 B.10 C.2 D.12
9、能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A.向水中投入一小块金属钠 . B.将水加热煮沸.
C.向水中通入二氧化碳气体. D.向水中加食盐晶体
10、有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义AG=lg([H+]/[OH-])。下列表述正确的是
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,若溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
11、设NA为阿伏加德罗常数,下列说法正确的是
A.1L0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个
B.1L0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C.2L0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D.0.1mol/L的H3PO4溶液中,[H+]∶[PO43-]<3∶1
12、在一定条件下发生下列反应,其中属于盐类水解反应的是
A.NH4+ +2H2O ![]() NH3·H2O + H3O+
NH3·H2O + H3O+
B.HCO3- + H2O
![]() H3O+ + CO32-
H3O+ + CO32-
 C.HS-+H+=== H2S
C.HS-+H+=== H2S
D.Cl2+H2O ![]() H++Cl-+HClO
H++Cl-+HClO
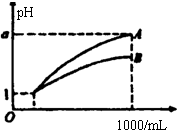
13、pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
14、CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,pH为4.7。下列说法错误的是
A.CH3COOH的电离作用大于CH3COONa的水解作用
B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解
D.CH3COONa的存在抑制了CH3COOH的电离
15、某元素X的相对原子质量为a,它的最高氧化物的水化物的分子式为HmXOn(m>1)。
下列有关叙述中一定正确的是
A.该酸的水溶液中,c(H+)∶c(XO![]() )=n∶1 B.该酸的摩尔质量为(m+a+16n)g
)=n∶1 B.该酸的摩尔质量为(m+a+16n)g
C.100 mL该酸溶液,能中和4g NaOH
D.若0.1molL-1该酸溶液的pH=1,则NamXOn的水溶液的pH>7
| 选择题答案 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
二、填空题
16、下列物质中,能导电的是__________________,属于强电解质的是____________
属于非电解质的是________________(均填序号)
①Cu②液氨③氯水④氯化钠晶体⑤硫酸溶液⑥干冰⑦BaSO4⑧液氧⑨金刚石⑩石墨
17、有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)如果加入蒸馏水,应加入________ mL
(2)如果加入pH = 10的NaOH溶液,应加入_________ mL
(3)如果加入0.008 mol/L HCl溶液,应加入__________ mL
18、配制氯化铁溶液常出现浑浊现象,其原因是___________________________。
如何操作既可得到透明溶液而又不引进杂质离子____________________________
_______________________________________
19、写出下列溶液中的水解方程式
(1)Fe2(SO4)3溶液:
(2) Al2S3溶液:
(3) Na2CO3溶液:
三、实验题
20、某烧碱样品中含有少量不与酸作用的杂质,为了测定其纯度进行以下滴定操作:
A、 在250mL的容量瓶中定容配成250mL烧碱溶液
B、 用移液管移取25mL烧碱溶液于锥形瓶中滴几滴甲基橙作指示剂
C、 在天平上准确称取W g烧碱样品,在烧杯中用蒸馏水溶解
D、将物质的量浓度为M的标准硫酸溶液装入酸式滴定管,调节液面记下开始读数为V1mL
E、 在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2mL
就此实验完成下列填空:
(1) 正确操作步骤的顺序是(用编号字母填写)
→ → →D→
(2) 观察滴定管里液面的高度时应注意:
(3) E步骤的操作中在锥形瓶下垫一张白纸的作用是
(4) D步骤的操作中液面应调节到 ,尖嘴部分应
(5) 某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度偏高还是偏低? ;原因是
(6) 该烧碱样品纯度的计算式为
21、为测定冰醋酸(纯净的醋酸,不含水分)在加水稀释的过程中溶液导电能力的变化,某学生用下图所示仪器设计了一个实验。
(1) 请将下面所示仪器间没有连接的部分用导线连接起来完成本实验。
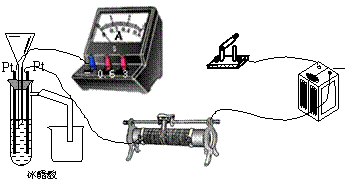 |
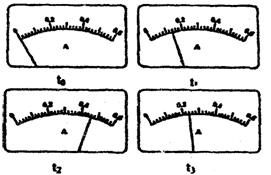 (2)电路开关闭合为t0时刻,之后向长颈漏斗中持续加入蒸馏水,并分别在t1、t2、t3时刻观察到电流计指针的偏转情况如下(其中t1<t2<t3,且在实验全过程中,t2时刻电 流计指针偏转为最大)
(2)电路开关闭合为t0时刻,之后向长颈漏斗中持续加入蒸馏水,并分别在t1、t2、t3时刻观察到电流计指针的偏转情况如下(其中t1<t2<t3,且在实验全过程中,t2时刻电 流计指针偏转为最大)
请据此信息分析,在t1到t2的过程中,溶液中[H+](填“增大”“减小”或“不变”)__________;继续加水,在t2到t3的过程中,溶液中[H+](填“增大”“减小”或“不变”)___________;请用简要文字解释冰醋酸在稀释过程中[H+]变化的原因________________________________________________ __
四、计算题:
22、向200mL稀硫酸和盐酸的混合液中加入0.3mol/L的Ba(OH)2溶液200mL,充分反应后,过滤、干燥,得到沉淀4.66g,滤液pH为13。求原溶液中HCl和H2SO4物质的量浓度各是多少?