高二化学第三章单元检测试卷
一、选择题
1.下列物质中,属于强电解质的物质是( )
A.K2SO4 B.H2SO3 C.CH3COOH D.NH3·H2O
2.0.1mol/L的乙酸溶液用水稀释后,下列说法不正确的是( )
A.H+数目增多 B.有利于乙酸的电离
C.c(H+)必增加 D.导电性减弱
3.下列电离方程式中正确的是( )
A.NH3·H2O ==== NH4++OH-
B.NaHSO3 ====Na++H++SO32-
![]() C.H2SO3 ====2H++SO32-
C.H2SO3 ====2H++SO32-
D.NaHCO3 =====Na++HCO3-
4.在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是( )
A.pH= 3的硝酸和pH=11的氢氧化钾溶液
B.pH= 3的盐酸和pH=11的氨水
C.pH= 3的硫酸和pH=11的氢氧化钠溶液
D.pH= 3的醋酸和pH=11的氢氧化钡溶液
5.下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液中 CH3COOH+NH3=CH3COONH4
B.澄清石灰水跟盐酸反应 H++OH-=H2O
C.碳酸钡溶于盐酸 BaCO3+2H+=Ba2++H2O+CO2↑
D.金属钠跟水反应 Na+2H2O=Na++2OH-+H2↑
6.纯水在85℃和20℃时的pH,前者与后者比较( )
A.前者大于后者 B.前者小于后者
C.前者等于后者 D.不能肯定
7.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
A.H+、Na+、S2O32-、Cl- B.K+、Fe2+、SO42-、NO3-
C.Na+、OH-、SO42-、HCO3- D.Cu2+、Ba2+、SO32-、SO42-
8.物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX
C.HX、HY、HZ D.HY、HZ、HX
9.某溶液pH=6,此溶液加水稀释,体积扩大100倍,则此溶液的pH是( )
A.等于8 B.等于7
C.小于7但接近于7 D.无法判断
10.在下面的式子中属于水解反应,且溶液呈酸性的是( )
![]() A.HCO3-+H2O CO32-+H3O+
A.HCO3-+H2O CO32-+H3O+
B.SO3+H2O == H2SO4
![]() C.NH3+H2O NH4++OH-
C.NH3+H2O NH4++OH-
D.NH4++H2O NH3·H2O +H+
11.pH相同的盐酸和醋酸溶液分别与锌反应,若锌全部溶解,且放出的气体质量相等,则下列判断正确的是( )
A.整个反应阶段平均速率:醋酸>盐酸
B.反应所需时间:盐酸<醋酸
C.开始反应速率:盐酸>醋酸
D.参加反应的锌的质量:盐酸 = 醋酸
12.把等体积等物质的量浓度的CH3COONa溶液跟盐酸混合后,溶液中的微粒浓度大小比较正确的是( )
A.c(Na+)=c(Cl-)=c(H+)=c(CH3COO-)=c(CH3COOH)
B.c(Na+)=c(Cl-)>c(CH3COOH)>c(H+)>c(CH3COO-)
C.c(Na+)>c(Cl-)> c(CH3COOH)>c(H+)>c(CH3COO-)
D.c(Na+)=c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)
13.下列说法中,不正确的是( )
①体积相同、pH相同的盐酸和醋酸与碱中和时,消耗碱的量相同
②pH为4的溶液中c(OH-)是pH为2的溶液中c(OH-)的2倍
③在0.1mol/L的醋酸中加入少量硫酸后,溶液中醋酸分子的浓度减小
④pH=3的盐酸和pH=5的盐酸等体积混合后,所待溶液的pH为3.3
A.只有① B.只有①和②
C.①②和③ D.①②③④
 14.要使FeCl3+3H2O Fe(OH)3+3HCl水解程度增大,可采用( )
14.要使FeCl3+3H2O Fe(OH)3+3HCl水解程度增大,可采用( )
A.加少量盐酸 B.加入AgNO3溶液
C.加热 D.加压
15.当CH3COOH CH3COO-+H+达到电离平衡时,要使溶液的pH减小,醋酸的浓度增大,应向溶液中加入( )
A.H2O B.CH3COONa C.HCl D.NH3·H2O
16.下列物质中由于水解而使溶液呈碱性的是( )
A.NaHSO4 B.CH3COONH4 C.Na2CO3 D.NH4Cl
17.下列叙述正确的是( )
A.凡使酚酞变无色的溶液一定是酸溶液
B.使甲基橙变黄色的溶液不一定是碱溶液
C.使石蕊变红色的一定是酸溶液
D.使石蕊变蓝色的一定是碱溶液
18.某一元强酸稀溶液和一元弱碱稀溶液等体积混合后,溶液的pH=7,则以下叙述错误的是( )
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液的物质的量浓度小于碱溶液
C.酸溶液中c(H+)大于碱溶液中c(OH-)
D.两溶液的物质的量浓度相等
19.下列各组离子在溶液中能大量共存的是( )
A.Fe2+、NH4+、H+、Cl-、NO3- B.K+、Mg2+、Cl-、Br-、OH-
C.Ca2+、Cu2+、Na+、NO3-、SO42- D.Al3+、K+、NH4+、SO42-、NO3-
20.已知一种pH=3的酸溶液和一种pH=11的碱溶液等体积混合后溶液呈碱性,其原因可能是( )
A.稀的强酸溶液和浓的强碱溶液反应
B.浓的弱碱溶液和稀的强酸溶液反应
C.等浓度的强碱和弱酸溶液反应
D.生成了一种强碱弱酸盐
21.把碳酸氢钠作发酵物使用,若同时加入少量明矾,可显著提高发酵效率,其原因是( )
A.明矾起了催化作用
B.铝盐在水中起到酸的作用
C.明矾比碳酸氢钠易分解
D.铝盐受热分解放出气体
22.下列各溶液混合后,溶液的pH最大的是( )
A.0.05mol/L的H2SO4和0.1 mol/LNaOH溶液各10mL
B.0.1 mol/L 的H2SO4和0.1 mol/LNaOH溶液各10mL
C.0.1 mol/L 的醋酸和0.1 mol/LNaOH溶液各10mL
D.0.1 mol/L的硝酸和0.1 mol/L NH3·H2O各10mL
23.下列说法中,正确的是( )
A.在NaCl溶液中,c(Na+)=c(Cl-)
B.在碳酸溶液中,c(H+)=2c(CO32-)
C.在K2CO3溶液中,c(K+)=2c(CO32-)
D.在NaHCO3溶液中,c(Na+)>c(HCO3-)>c(CO32-)
二、填空题:
![]() 24.在0.1mol/L稀氨水中存在以下平衡:NH3·H2O NH4++OH-(正反应吸热),按表中要求填写当外界条件改变时,对稀氨水的电离平衡和pH的影响。
24.在0.1mol/L稀氨水中存在以下平衡:NH3·H2O NH4++OH-(正反应吸热),按表中要求填写当外界条件改变时,对稀氨水的电离平衡和pH的影响。
| 改变的外界条件 | 加少量NaOH | 加适量水 | 降温 |
| 电离平衡移动方向 | |||
| 溶液的pH |
25.碳酸氢钠溶于水后,既能发生电离也能水解。
电离方程式 ________________________________
水解的离子方程式 ________________________________
它的水溶液呈______性,其pH______7(填“大于”或“小于”)
在碳酸氢钠的水溶液里加入下列物质,反应的离子方程式:
①加盐酸________________________________
②加氢氧化钡溶液________________________________
③加硫酸氢钠溶液________________________________
④加氢氧化钠溶液________________________________
三、简答题:
26.在氯化铁溶液中,加入难溶于水的碳酸钙粉未,可见碳酸钙逐渐溶解,产生无色气体和红棕色沉淀。试用电解质理论进行简要分析,并写出相关离子反应方程式。
四、计算题:
27.在1L溶液里含有3.65g氯化氢。试计算:
(1)该溶液中所含溶质的物质的量
(2)该溶液中所含溶质的物质的量浓度
(3)该溶液中的c(H+)
(4)该溶液中的c(OH-)
(5)该溶液的pH
28.把25mL0.2mol/L盐酸与25mL 0.4mol/L氢氧化钠溶液完全反应,求反应完成后混合溶液的pH。
29.向28.4g25%的硫酸钠溶液中加入40g过量的氢氧化钡溶液,完全反应后,滤去沉淀。向滤液中滴加30mL20%的稀硫酸(密度为1.147g/cm3),恰好中和至中性。试求:
(1)滤出的沉淀的质量是多少克?
(2)原氢氧化钡溶液的质量分数是多少?
答案及评分标准
一、共56分。1~13小题每题2分,错选全扣,少选扣1分;14~23小题每题3分,错选全扣,少选扣2分。
1.A 2.C 3.D 4.D 5.BC 6.B 7.A 8.C 9.C
10.D 11.AD 12.B 13.C 14.C 15.C 16.C 17.B 18.AD
19.D 20.B 21.B 22.C 23.AD
二、共20分
24.每空1分,共6分。
逆向移动 正向移动 逆向移动
增大 减小 减小
25.共14分
![]() NaHCO3 === Na++HCO3- HCO3- H++CO32- (各1分)
NaHCO3 === Na++HCO3- HCO3- H++CO32- (各1分)
![]() HCO3-+H2O H2CO3+OH- (2分)
HCO3-+H2O H2CO3+OH- (2分)
碱;大于 (各1分)
①HCO3-+H+=H2O+CO2↑
②Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- 或写成
Ba2++OH-+HCO3-=BaCO3↓+H2O
③H++HCO3-=H2O+CO2↑
④OH-+HCO3-=H2O+CO32- (各2分)
三、26.5分
![]() Fe3+水解使溶液呈酸性;Fe3++3H2O Fe(OH)3+3H+
Fe3+水解使溶液呈酸性;Fe3++3H2O Fe(OH)3+3H+
加入CaCO3后,H+和CaCO3发生反应;
CaCO3+2H+=Ca2++H2O+CO2↑,CaCO3逐渐溶解,产生无色气体,同时由于H+减少,使Fe3+的水解平衡正向移动,生成红棕色的Fe(OH)3沉淀。
四、共19分
27.5分,每问1分
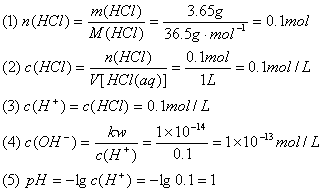
28.6分
n(HCl)=c(HCl)·V[HCl(aq)]=0.2mol/L×0.025L=0.005mol
n(NaOH)=c(NaOH) ·V[NaOH(aq)]=0.4mol/L×0.025L=0.01mol
HCl+NaOH=NaCl+H2O
NaOH过量0.01mol-0.005mol=0.005mol
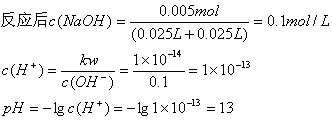
29.8分,每问4分
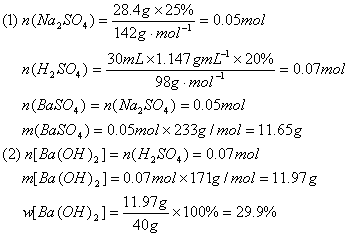
部分试题思路点拨
4.A.pH=7 B.氨水浓度大,过量,pH>7 C.n(H+)=n(OH-),pH=7
D.醋酸浓度大,过量,pH<7
6.升温,水电离平衡正向移动,c(H+)增大,pH小。
7.A、H+和S2O32-发生氧化还原反应。
B、Fe2+和NO3-在无大量H+条件下可以共存。
8.盐pH越大,水解程度越大,对应酸越弱。
11.HCl和CH3COOH pH相同,则CH3COOH浓度一定大,所以和Zn反应放出H2一样时,CH3COOH一定过量,HCl可能恰好完全反应也可能过量,但Zn质量相同,D正确。
开始时c(H+)相同,所以反应速率相等,C不正确。随反应进行HClpH减小很多,而CH3COOH中由于随H+浓度减小 ,电离平衡正向移动,所以c(H+)要大于HCl和c(H+),反应速率比HCl快,A正确。反应速率快,则醋酸产生同样H2所需时间少,B不正确。
12.混合后反应为等物质的量的NaCl和CH3COOH。
13.(1)醋酸浓度大,消耗碱多
(2)应为100倍
(3)加入H+,电离平衡逆向移动,CH3COOH分子浓度增加
![]()
14.A、加H+,平衡逆向移动
B、加AgNO3对平衡无影响
D、无气体加压时平衡无影响
15.A、pH增大,CH3COOH浓度减小
B、pH增大,CH3COOH浓度增大
C、pH增大,CH3COOH浓度减小
18.因反应生成强酸弱碱盐显酸性,而此时pH=7,则一定是弱碱过量。则碱的浓度大。B对,A、D不对。而若酸电离出c(H+)小于或等于碱电离出的c(OH-),则弱碱过量很多,使pH>7,因此C对。
20.若为强酸、强碱,则pH=7
若为弱酸,强碱,则弱酸过量,pH<7
若为强酸,弱碱,则弱碱过量,pH>7
22.A、pH=7
B、H+过量,pH<7
C、恰好反应,生成CH3COONa,pH>7
D、恰好反应,生成NH4NO3,pH<7