![]()
|
|
学科:化学 |
| 教学内容:高二化学第四章 综合能力测试 |
【同步达纲练习】
一、选择题
1.将2.6g金属混合物的粉末跟足量的盐酸反应,生成2.24LH2(标况),则此金属混合物可能是( )
A.Mg和Al B.Al和Fe C.Fe和Zn D.Zn和Mg
2.在无色透明的强酸性溶液中,能大量共存的离子组是( )
A.Na+、Mg2+、![]() 、
、![]() B.NH+4、Al3+、
B.NH+4、Al3+、![]() 、Cl-
、Cl-
C.K+、Na+、![]() 、
、![]() D.Mg2+、K+、
D.Mg2+、K+、![]() 、OH-
、OH-
3.将Fe片和Cu片用导线连接置于稀硫酸溶液中,下列的说法中错误的是( )
A.Fe片的质量逐步增加
B.溶液的PH逐渐增大
C.正极附近的![]() 浓度逐渐增大
浓度逐渐增大
D.负极上有大量气泡放出,说明铁片不纯.
4.将过量铁粉放入200ml1mol/L的HNO3溶液中,若还原产物只有NO,则参加反应的Fe的质量为( )
A.4.2g B.5.6g C.2.8g D.11.2g
5.向500mlFeCl3溶液中通入一定量的H2S气体,恰好使FeCl3完全反应,过滤后所得滤液的质量比原溶液增加1g,则原FeCl3溶液的物质的量浓度为( )
A.1mol/L B.2mol/L C.0.5mol/L D.1.5mol/L
6.下列离子方程式中,正确的是( )
A.Al(OH)3与稀H2SO4反应:2Al(OH)3+6H+=2Al3++6H2O
B.Al2(SO4)3中加入过量氨水:Al3++3OH-=Al(OH)3↓
C.Al2(SO4)3与Ba(OH)2溶液反应:![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
D.偏铝酸钠溶液与少量稀HNO3反应:AlO-2+H++H2O=Al(OH)3↓
7.在下面图中横坐标为向一定量的某溶液中加入某物质的量,纵坐标为生成沉淀的量.从A—E中,选择适合各题要求的序号填空
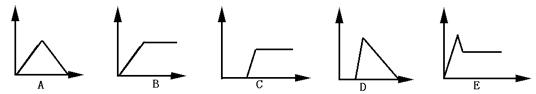
| 溶液 | 加(通)入物质 | 序号 |
| (1)饱和石灰水 | 通入过量CO2 | |
| (2)AlCl3溶液 | 加入过量氨水 | |
| (3)含少量NaOH的NaAlO2溶液 | 通入过量CO2 | |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀HCl | |
| (5)MgCl2、AlCl3混合液 | 逐滴加入NaOH溶液至过量 | |
| (6)NaOH溶液 | 逐滴加入AlCl3溶液至过量 |
8.只用一种试剂就可将AgNO3、KSCN、稀H2SO4和NaOH四种无色溶液分开,这种试剂是( )
A.BaCl2溶液 B.FeCl2溶液
C.FeCl3溶液 D.Fe(NO3)3溶液
二、填空题
9.高温灼烧孔雀石[Cu2(OH)2·CO3]和木炭的混合物可得到一种紫红色光泽的金属,其发生的化学反应方程式 , .
10.在由FeCl3和FeCl2组成的混合液中加入铁粉和铜粉,用玻璃棒搅拌使之充分反应.若不考虑阴离子,根据下列情况回答:
(1)若最终余下铁粉和铜粉,则溶液中没有 离子,只有 离子.
(2)若只剩余铜粉,则溶液中没有 离子,而有 离子,还可能有 离子.
(3)若铁粉和铜粉均全部溶解,则溶液中一定还有 离子,可能还有 离子.
11.1958年世界上第一个心脏起搏器在瑞典植入人体成功,使用寿命长达10年之久.这种能源起搏器中安装寿命最长.可靠性最高的锂—碳电池,这种电池容量大,电压稳定,能在-56.7℃~71.1℃范围内正常工作,现已在火箭、移动电话、笔记本电脑中广泛使用.它采用锂和石墨作电极,LiAlCl4溶解在SOCl2中组成电解质溶液.电池总反应为:
8Li+3SOCl2=6LiCl+Li2SO3+2S
(1)此电池中 作负极,电极反应为 , 作正极.
(2)该电池用于心脏起博器时,在生理上的作用是 .
三、实验题
12.镁是很活泼的金属,在电子工业中利用镁制取硅的反应为:2Mg+SiO2![]() 2MgO+Si+373KJ,同时有副反应:2Mg+Si
2MgO+Si+373KJ,同时有副反应:2Mg+Si![]() Mg2Si发生,Mg2Si遇盐酸迅速反应生成SiH4(甲硅烷),SiH4常温下是一种不稳定,易分解的气体.
Mg2Si发生,Mg2Si遇盐酸迅速反应生成SiH4(甲硅烷),SiH4常温下是一种不稳定,易分解的气体.
(1)图甲是进行Mg和SiO2反应的实验装置.
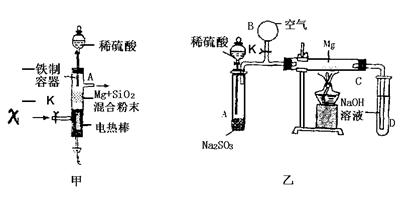
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气.X气体应选用:
①H2 ②N2 ③CO2中的 (填序号)
Ⅱ.实验开始时,必须先通入X气体后,再接通电源加热反应物,其理由是 .当反应引发后,切断电源,反应能继续进行,其原因是 .
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗加入稀HCl,可观察到导管口A处有闪亮的火星.据此现象可推知 在空气中能自燃.
(2)图乙所示装置的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质.实验完毕后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为 .
Ⅱ.停止实验时,先打开K,再停止滴加浓H2SO4并熄灭酒精灯.橡标胶气胆B在实验中的作用是 .
Ⅲ.C中全部生成物有 、 、 .(填化学式)
四、计算题
13.准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol·L-1的NaOH溶液,产生沉NaOH溶液的体积的关系如下图所示:
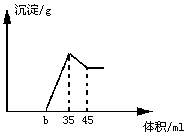
(1)H2SO4的物质的量浓度.
(2)若b=23,则铝土矿中各成分的质量分数分别是多少?
(3)b值范围在 之间,在这个范围内,b值越大, 的含量越小.

参考答案:
【同步达纲练习】
1.BD 2.B 3.AC 4.A 5.B 6.AD 7.(1)A (2)B (3)C (4)D (5)E (6)C 8.C
9.Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
2CuO+C![]() 2CuO+CO2↑
2CuO+CO2↑
10.(1)Fe3+、Cu2+;Fe2+ (2)Fe3+;Fe2+;Cu2+
(3)Fe2+、Cu2+;Fe3+
11.(1)Li;Li-e![]() Li+;石墨
Li+;石墨
(2)起搏器遵循天然心脏的工作原理,通过向心脏发送电脉冲以控制心脏的跳动
12.(1)Ⅰ① Ⅱ防止在加热条件下,H2与空气混合发生爆炸;Mg与SiO2发生放热反应;Ⅲ SiH4
(2)Ⅰ加热条件下Mg与玻璃中的SiO2反应.
Ⅱ防止C降温时因C中气体压强减小而引起D中溶液倒流.
ⅢMgO, S, MgS 13.(1)1.75mol·L-1 (2)Al2O3%=85% Fe2O3%=12% SiO2%=3%
(3)1.625<b<5;Fe2O3
