高二化学第一学期第二次月考(普通班)
试卷
命题、校对:肖利全
一、单项选择(5×4’=20’)
1、下列物质中, 能使铁溶解, 又不生成沉淀和气体的是
A.稀硫酸 B.浓硝酸 C.硝酸银溶液 D.硫酸铁溶液
2、下列各组括号内的试剂, 不能用于除掉物质中杂质的是
A.Fe粉中混有Zn粉杂质(稀H2SO4) B.FeCl3中混有FeCl2杂质(Cl2)
C.CO气体中混有CO2杂质(NaOH溶液) D.SiO2中混有CaCO3杂质(盐酸)
3、在高温下用一氧化碳还原m克Fe3O4得到n克铁。已知氧的原子量为16, 则铁的原子量为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
4、在相同体积的KI、FeCl2、FeBr2的溶液里, 分别通入足量的氯气并且发生完全充分反应, 若它们耗用Cl2的质量相同, 则KI、FeCl2、FeBr2三种溶液的物质的量浓度比
A.6∶3∶2 B.1∶3∶3 C.3∶3∶1 D.1∶2∶3
5、只用一种试剂可区别![]() 五种溶液, 这种试剂是
五种溶液, 这种试剂是
A.Ba(OH)2 B.H2S C.NaOH D.AgNO3
二、不定项选择(15×4’=60 ’)
6、某溶液中有![]() 四种离子, 若向其中加入过量的氢氧化钠溶液, 微热并搅拌, 再加入过量盐酸; 溶液中大量减少的阳离子是
四种离子, 若向其中加入过量的氢氧化钠溶液, 微热并搅拌, 再加入过量盐酸; 溶液中大量减少的阳离子是
A.![]() B.Mg2+ C.Fe2+ D.Al3+
B.Mg2+ C.Fe2+ D.Al3+
![]() 7、镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是:
7、镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是:![]() H2+NiO(OH)
Ni(OH)2。根据此反应式判断,下列叙述正确的是
H2+NiO(OH)
Ni(OH)2。根据此反应式判断,下列叙述正确的是
A.电池放电时,电池负极周围溶液的PH不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,氢气是负极
8、下列离子方程式中正确的是
A.三氯化铁溶液中加入铁粉 ![]()
B.氯化镁溶液中加入硝酸银溶液 ![]()
C. 过量氯气通入溴化亚铁溶液中 ![]()
D.氢氧化铜溶于稀硫酸中 ![]()
9、甲乙两烧杯各盛有0.5升x摩 / 升稀硫酸, 向甲中加入m克Fe, 向乙中加入m克Zn, 完全反应后, 有一烧杯内仍有残留金属, 则x的范围是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
10、在含有a克硝酸的稀溶液中, 加入b克铁粉充分反应, 铁全部溶解, 生成NO, 已知有![]() 克HNO3被还原, a∶b则不可能为
克HNO3被还原, a∶b则不可能为
A.2∶1 B.3∶1 C.4∶1 D.9∶2
11、将Na2O2投入FeCl2溶液中, 可观察到的现象是
A.生成白色沉淀 B.生成红褐色沉淀 C.有气泡产生 D.无变化
12、下列各组金属混合物质量相同,它们分别和足量盐酸反应,在相同状况下产生H2的体积也相同,则其中Zn的质量分数最高的是:
A.Zn和Al B.Zn和Fe C.Zn和Mg D.Zn和Na
13、在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是:
A.![]() B.
B.![]()
C.![]() D.
D.![]()
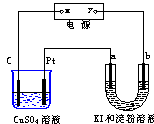 14、如图所示装置中,a、b都是惰性电极,通电一段时间后,
14、如图所示装置中,a、b都是惰性电极,通电一段时间后,
b极附近溶液呈蓝色。下列说法中正确的是:
A.x是正极,y是负极。
B.x是负极,y是正极。
C.a极和Pt都有气泡产生。
D.CuSO4溶液PH值保持不变,U形管溶液PH值增大。
15、下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②(NH4)2S ③Al2O3 ④Al(OH)3 ⑤Al
A.③④ B.③④⑤ C.①③④⑤ D.全部
16、在调整好的天平左右两盘中各放一只质量相等的烧杯,两烧杯中均盛有1mol/L的稀H2SO4 100mL,然后分别向烧杯中加入一定量的Mg和Al,充分反应后,天平仍保持平衡,则镁、铝的量分别为:
A.2.4克Mg、1.8克Al B.5克Mg、5克Al
C.2.4克Mg、2.7克Al D.0.9克Mg、0.9克Al
17、用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL ![]() NaCl溶液和
NaCl溶液和![]()
![]() 的
的![]() 溶液,当产生
溶液,当产生![]() (标准状况)
(标准状况)![]() 时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL)
时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL)
A.1.4 B.5.6 C.7 D.无法确定
18、用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复原浓度、原体积,应加入的适量适当物质是
A.CuSO4 B.CuSO4·5H2O C.CuO D.Cu(OH)2
19、阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为:2H2+O2=2H2O,电解液为KOH,反应保持较高的温度,使H2O蒸发,下列叙述正确的是
A.此电池能发出蓝色火焰
B.H2为正极,O2为负极
C.工作时,电解液的pH不断减小
![]()
20、锌、溴蓄电池的充、放电的电池总反应为 ![]()
![]()
下列各反应:①![]() ②
②![]() ③
③![]() ④
④![]() ,其中充电时的阳极和放电时的负极的反应分别是:
,其中充电时的阳极和放电时的负极的反应分别是:
A.①② B.③① C.④② D.③②
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、天空题(共50’)
21、(12’)由单质A与化合物B两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:
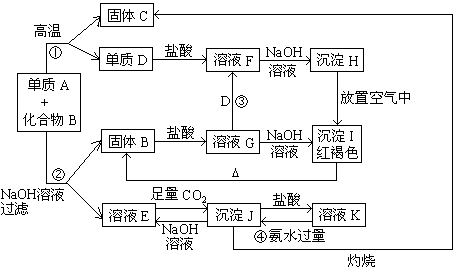
请回答:
(1)A的化学式 ; B的化学式
(2)反应①的化学方程式
(3)反应②的离子方程式
(4)反应③的离子方程式
(5)反应④的离子方程式
22、(3’)与足量盐酸反应后产生H2量相同,则所加入Na、Mg、Al三种金属质量比为
23、(6’)某无色溶液里, 只含有下列八种离子中的某几种:
Mg2+、Na+、H+、Ag+、Cl-、![]() 。已知该溶液能跟金属铝反应, 且放出的气体只有氢气试回答:
。已知该溶液能跟金属铝反应, 且放出的气体只有氢气试回答:
(1)若溶液跟Al反应后有![]() 生成, 则原溶液一定含有大量的 离子, 还可能含有大量的 离子。
生成, 则原溶液一定含有大量的 离子, 还可能含有大量的 离子。
(2)若溶液跟Al反应后有Al3+生成, 则原溶液中一定不含有大量 离子。
24、(10’)在一定条件下可实现下图所示物质之间的变化
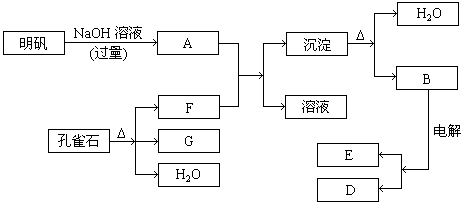
请填写以下空白:
(1)孔雀石的主要成份是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中的F是
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式
(3)图中所得G和D都为固体混合后在高温下可发生反应写出该反应化学方程式
(4)每生成1mol D同时生成 mol E
25、(19’)由于![]() 极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的
极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的![]() 沉淀。若用右图所示实验装置可制得纯净的
沉淀。若用右图所示实验装置可制得纯净的![]() 沉淀。两极材料分别为石墨和铁。
沉淀。两极材料分别为石墨和铁。
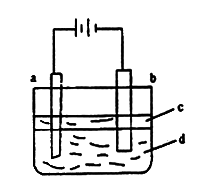
①a电极材料为 ,其电极反应式为 。
②电解液d可以是 ,则白色沉淀在电极上生成;也可以是 ,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.![]() 溶液 C.
溶液 C.![]() 溶液 D.
溶液 D.![]() 溶液
溶液
③液体c为苯,其作用是 ,在加入苯之前,对d溶液进行加热处理的目的是 。
④为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度
⑤若d改为![]() 溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为
。
溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为
。
四、计算题(10’+10’=20’)
26、铁粉和氧化铁粉末的混合物共48.8克, 加入到700毫升的稀硫酸中, 恰好完全反应, 得到氢气2.24升(标准状况)向反应后的溶液中滴入NH4SCN溶液, 搅拌均匀, 溶液未见红色, 求:
(1)混合物中铁和氧化铁的质量?
(2)原稀硫酸的物质的量浓度?
29、取500mL 4.84 mol/L的食盐水(ρ=1.18g/mL),以石墨做电极电解,在标准状况下,阳极上放出5600mL气体。若电解前后溶液的体积变化忽略不计,求:
(1)请写出阴极和阳极的电极反应方程式
(2)电解后溶液的PH值约是多少?
(3)电解后食盐的物质的量浓度是多大?
第一学期第二次月考
高二化学试卷(普通班)(参考答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | B | C | C | A.C | CD | BD | B | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | BC | A | A | BC | D | B | C | C | D | B |
三、填空题
21、(1)A的化学式Al B的化学式Fe2O3
(2)2Al
+ Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
(3)![]()
(4)![]()
(5)![]()
22、23:12:9
23、(1)![]()
![]()
(2)![]()
24、(1)CO2
(2)![]()
(3)3CuO
+ 2Al![]() 3Cu + Al2O3
3Cu + Al2O3
(4)![]()
25、①Fe;![]()
②C; B
③隔绝空气防止![]() 被空气氧化;排尽溶液中的氧气,防止生成的
被空气氧化;排尽溶液中的氧气,防止生成的![]() 在溶液中氧化
在溶液中氧化
④B、C
⑤白色沉淀迅速变化成灰绿色,最后变成红褐色
四、计算题
26、(1)Fe::16.8 g Fe2O3:32g
(2)1 mol/L
27(1)阴极:2H++2e-=H2↑ 阳极:2Cl—-2e-=Cl2↑
(2)PH=14 (2)3.84mol/L