高二化学第一学期第二次月考
试题
本卷完成时间:90分钟 满分:150分
原子量表:铁56 镁24 铝27 铍9 锌 65 铜64 钡137
一、选择题:(每题3分)
1、地壳中硅、氧、铁、铝四种元素的含量大小顺序正确的是
A.硅>氧>铝>铁 B.氧>硅>铝>铁 C.氧>硅>铁>铝 D.硅>氧>铁>铝
2、下列关于铁的叙述错误的是
A.纯净的铁是光亮的银白色金属
B.铁能被磁体吸引,在磁场作用下,铁自身也能产生磁性
C.铁是地壳中含量最多的金属元素,所以分布在地壳中的铁有游离态也有化合态
D.纯铁的抗蚀能力相当强,铁在干燥的空气里不易被氧化
3、下列试剂不能使Fe2+转化为Fe3+的是
①氯气 ②硫化钠溶液 ③高锰酸钾溶液 ④稀硝酸 ⑤磷酸溶液 ⑥KSCN
A.①②③ B.①③④ C.④⑤⑥ D.②⑤⑥
4、下列各组离子在强酸性、无色透明溶液中能大量共存的是( )
A、K+、Fe3+、![]() 、Cu2+
B、K+、
、Cu2+
B、K+、![]() 、
、![]() 、Na+
、Na+
C、![]() 、Al3+、
、Al3+、![]() 、NO3—
D、Fe3+、
、NO3—
D、Fe3+、![]() 、Na+、S2-
、Na+、S2-
 5、目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的
5、目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的![]() ”—Al2O3陶瓷作固体电解质,反应如下:2Na + xS Na2Sx,以下说法正确的是
”—Al2O3陶瓷作固体电解质,反应如下:2Na + xS Na2Sx,以下说法正确的是
A.放电时钠作正极,硫作负极 B.放电时钠极发生还原反应
C.放电时钠作负极,硫作正极 D.放电时负极发生的反应是xS-2e = Sx2-
6、下列各组物质中,前一种与后两种物质反应后不能产生同一种气体的是
A.铝、氢氧化钠溶液、盐酸 B.硫化铵、氢氧化钠溶液、盐酸
C.水、过氧化钠、氟气 D.碳酸氢钠、硫酸氢钠溶液、盐酸
7、燃烧镁和某金属组成的合金,所形成的氧化物的质量为反应前合金质量的2倍,则另一种金属可能是
A.铜 B.铍 C.钠 D.铝
8、在稀硫酸中加入适量铁粉,反应完全后再加入适量氢氧化钠溶液,放置片刻,从反应体系中观察到的颜色变化是
A.无色→灰绿色→红褐色 B.无色→浅绿色→白色→灰绿色→红褐色
C.灰绿色→红褐色→蓝色 D.无色→白色→浅绿色→灰绿色→红褐色
9、下列关于烃的叙述中正确的是 ( )
A 凡含有碳原子和氢原子的物质叫烃 B 含有碳氢两种元素的有机物叫烃
C 仅含碳和氢元素的化合物叫烃 D 通常状况下,烃都是气体
10、用铝热法从下列氧化物中还原出物质的量相同的各金属,耗铝最少的是( )
A、Cr2O3 B、MnO2 C、V2O5 D、WO3
二、选择题(每题5分)
11、Fe和Fe2O3的混合物Wg,取1/10将其放入100mL,0.1mol/L的稀H2SO4中,恰好完全反应,没有气体产生,反应后溶液中加入KSCN溶液,没有红色出现。若将Wg原混合物用CO 全部还原成Fe,其质量是
A、0.56g B、5.6g C、1.12g D、无法计算
12、右图是AlCl3、MgCl2的物质的量
浓度比为1:1的溶液中加入a或b时,
沉淀量与加入a与b的量关系图,以下
![]()
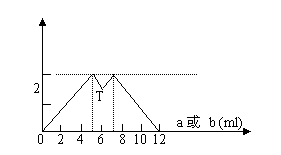 结论正确的是
结论正确的是
A.T之前加NaOH溶液,T之后加盐酸溶液
B.图中消耗NaOH与HCl的物质的量之比为3:1
C.T之前加盐酸,T之后加NaOH溶液
D.这种盐酸与NaOH溶液的物质的量浓度相等
13、2摩CH4和氯气反应,若要得到等物质的量的四种甲烷氯代物,则需氯气的物物质的量为:
A. 1 摩 B.2摩 C.4摩 D.5摩
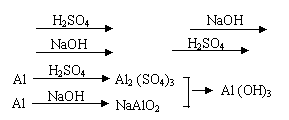 14、用稀H2SO4、NaOH溶液和金属铝为原料制取Al (OH)3,甲、乙、丙三个学生制备途径分别是:
14、用稀H2SO4、NaOH溶液和金属铝为原料制取Al (OH)3,甲、乙、丙三个学生制备途径分别是:
甲:Al Al2 (SO4)3 Al (OH)3
乙:Al NaAlO2 Al (OH)3
丙:
若要得到等量的Al (OH)3,则
A.三者消耗原料相同 B.甲消耗的原料最多
C.乙消耗原料最少 D.丙消耗的原料最少
15、把铁棒、Zn棒用导线连接插入CuSO4溶液中,当电路中有0.2 mol电子通过时,负极的质量变化为
A.增加6.5g B.减少6.5g C.减少5.6g D.增加6.4g
16、能使溶液中同时含有大量的NH4+、Fe3+、Cu2+、Cl-、SO42-离子的一组物质是
A.BaCl2、Cu (NO3)2、(NH4)2SO4、Na2S
B.CuCl2、NaNO3、Fe2 (SO4)3、NH4Cl
C.NaOH、FeCl3、(NH4)2SO4、CuSO4
D.FeCl3、H2S、Cu (NO3)2、NH4NO3
17、向明矾溶液里滴入Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是( )
A、一部分AL(OH)3沉淀,一部分以AL3+形式存在于溶液中
B、一部分为AL(OH)3沉淀,一部分以ALO2-形式存于溶液中
C、全部为AL(OH)3沉淀
D、几乎全部以ALO2-形式存在于溶液中
18、下列化学方程式正确的是 ( )
![]() A、适量CO2通入氯化钙溶液中:CaCl2+CO2+H2O CaCO3↓+2HCL
A、适量CO2通入氯化钙溶液中:CaCl2+CO2+H2O CaCO3↓+2HCL
![]()
![]() B、碳酸氢镁和过量石灰水反应:Mg(HCO3)2+Ca(OH)2 MgCO3↓+CaCO3↓+H2O
B、碳酸氢镁和过量石灰水反应:Mg(HCO3)2+Ca(OH)2 MgCO3↓+CaCO3↓+H2O
C、过量的氢氧化钠与氯化铝反应:Al3+ + 4OH- = AlO2- + 2H2O
D、氯化铁与铁反应:Fe3+ + Fe = 2Fe2+
三、填空题:
1、有一包硫酸铁和硫酸亚铁固体混合物,已知含铁元素的质量分数为31%,则混合物中含硫元素的质量分数是 。(3分)
2、在含有x mol三氯化铁和y mol氯化铜的水溶液里插入一块铁片,充分反应后取出,再称该铁片。(每空3分)
(1)若铁片质量和插入前相等,由x :y = ;
(2)若铁片质量比插入前增加了,则x和y的关系式是 ;
(3)若铁片质量比插入前减轻了,则x和y的关系式是 。
3、为除去下列各物质中含有的少量杂质,需加入适当的试剂,请把试剂填入相应的横线上(括号内是少量杂质)。(每空2分)
⑴二氧化硅(氧化钙),选用的试剂为 ;
⑵铁粉(铝粉),选用的试剂为 ;
⑶氯化铁(氯化亚铁),选用的试剂为 ;
⑷氯化亚铁溶液(氯化铁),选用的试剂为 ;
⑸铜粉(铁粉),选用的试剂为 ;
⑹氯化亚铁溶液(氯化铜),选用的试剂为 。
 4、制取纯净的氯化铜晶体(CuCl2·2H2O),主要的生产过程是:(1)将粗氧化铜(含少量铁)溶解在稀盐酸里,加热使之加快溶解,过滤,测得滤液的pH值为3;(2)将步骤(1)所得的滤液按下列步骤进行操作:
4、制取纯净的氯化铜晶体(CuCl2·2H2O),主要的生产过程是:(1)将粗氧化铜(含少量铁)溶解在稀盐酸里,加热使之加快溶解,过滤,测得滤液的pH值为3;(2)将步骤(1)所得的滤液按下列步骤进行操作:
已知(a)供选择的氧化剂有:高锰酸钾酸性溶液、重铬酸钾溶液(K2Cr2O7)、氯水、次氯酸钠溶液;(b)Cu2+、Fe2+在pH为4~5时不和水反应(即不水解),而Fe3+却几乎完全水解而沉淀。(每空3分)
试回答:
①X是 ,反应的离子方程式是 。
②Y物质应该具备的条件是 ,Y可以选用 。
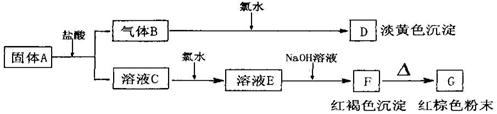 5、根据下列图示,回答问题:
5、根据下列图示,回答问题:
(1)写出下列物质化学式:A B E
F G ;(每空2分)
(2)写出下列变化的化学方程式: (每个方程式3分)
A→B+C: ; C→E:
6、用锌片、铜片和硝酸银组成的原电池,正极上发生的电极反应是__ ____。(3分)钢铁在潮湿的空气中容易发生_____(2分)腐蚀,发生腐蚀时,正极是____(2分),反应式为__ ___(3分),负极反应式为____ ___(3分)。
四、计算题:
1、 Al(OH)3、MgCO3及NaHCO3的混合物32.4加入过量盐酸,生成CO3气体4.48升(标况下);继续向反应后的溶液中加入过量NaOH溶液,生成5.8克白色沉淀。求该混合物中三种物质的质量百分含量。(7分)
2、 向1升1摩/升的溴化亚铁溶液中,通入标况下16.8升的氯气,使它们充分反应。溶液中存在的主要离子的物质的量浓度分别为多少?欲使溶液中中溴离子恰好完全被氧化,则应通入标况下的氯气多少升?(10分)
五、选做题(本题6分,加入总分,前面三大题总分为150分)
在500 mL硫酸铜和硫酸铁的混合液中加入 89.6g铁粉充分搅拌,完全反应后,滤出残留固体,洗涤干燥后称重,其质量为 86g。在滤液中加入 5 mol/L BaCl2 溶液310 mL,恰好使 SO42-完全沉淀。求原混合物中硫酸铜和硫酸铁的物质的量浓度。
第一学期第二次月考
高二化学试题答题纸
一选择题(每题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二选择题(每题5分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三填空题
1、 (3分)
2、(1) (3分)(2) (3分) (3) (3分)
3、(1) (2分)(2) (2分)(3) (2分)
(4) (2分)(5) (2分)(6) (2分)
4、①X是 ,(3分)
反应的离子方程式是 。(3分)
②Y物质应该具备的条件是 ,(3分)Y可以选用 。(3分)
5:(1)A B E F G (每空2分)
(2)A→B+C: ; (3分)
C→E: (3分)
6、用锌片、铜片和硝酸银组成的原电池,正极上发生的电极反应是__ ____。(3分)钢铁在潮湿的空气中容易发生_____(2分)腐蚀,发生腐蚀时,正极是____(2分),反应式为__ ___(3分),负极反应式为____ ___(3分)
四计算题
1、(7分)
2、(10分)
![]() 五、选做题(6分)
五、选做题(6分)
高二化学月考化学答案
一.选择题
1.B.2C.3D4.C.5.C6.B7.B8B9C10A.金属Mn+→M化合价越高得电子越多,需铝就多.
二.选择题
11.B反应后全部转变成硫酸亚铁,得FeSO40.01mol,根据铁守恒即可.
12.AD
13.D1molCH4和Cl2反应生成等物质的量的四种产物,需2.5molCl2
14.BD
15.B
16.B
17.D
18.C
三.填空题
1.23% Fe2(SO4)3与FeSO4中硫和氧的含量比是相同的,即S~O的质量比为1:2.所以硫元素的质量分数为(1-31%)×1/3=23%
2.(1)2:7 2FeCl3 + Fe=3FeCl2 CuCl2+Fe=Cu+FeCl2 ~ △m
xmol x/2mol ymol ymol ymol 8yg
x/2×56=8y x:y=2:7
(2)<2:7
(3)>2:7
3.(1)2)NaOH(3)Cl2(4)Fe(5)HCl(6)Fe(其它合适答案也可)
4.(1)氯水;Cl2+2Fe2+=2Fe3++2Cl-
(2)不引入新的杂质,CuO
5.(1)A. b.H2S E.FeCl3 F Fe(OH)3 G Fe2O3
(2)FeS+2HCl=FeCl2+H2S↑Cl2+2Fe2+=2Fe3++2Cl-
6.2Ag++2e-=2Ag 吸氧腐蚀性 碳 O2+4e-+2H2O=4OH- 2Fe-4e-=2Fe2+
四.
1.据题意:
Mg(OH)2 5.8g 为0.1mol MgCO3 0.1mol CO2 0.1mol
NaHCO3 与盐酸反应产生0.1mol CO2,NaHCO3为0.1mol
NaHCO3 :25.9% MgCO3:25.9% Al(OH)3 :48.2%
2.(1)cFe2+=1mol/L nFe2+=1mol nCl2=16.8L/22.4mol/L=0.75mol
Fe2+全部被氧化为Fe3+ 所以cFe3+=1mol/L 需nCl2=0.5mol
与Br-反应的Cl2为0.25mol,氧化Br- 0.5mol,溶液中仍有Br- cBr-=1.5mol/L cCl-=1.5mol/L
(2)需nCl2=0.75mol
五.先确定86克为何物(用极限法).
nSO42-=nBa2+=5×0.31=1.55mol
若原溶液均为硫酸铜,则需铁:1.55×56=86.8g<89.6g
若原溶液均为硫酸铁,则需铁:1.55×56/3=86.8/3g<89.6g
所以剩余固体是铁和铜.
CuSO4+Fe=Cu+FeSO4 △m
x x x x 8x
Fe2(SO4)3+Fe=3FeSO4
y y 3y
8x-56y=89.6-86=3.6 ………………①
x+3y=1.55 ………………②
x=0.95mol
y=0.2 mol