高二第一学期化学期末复习卷
(测试范围第一章~第三章,满分150分)
班级 姓名 成绩
可能用到的元素的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 P—31 S—32 Fe—56
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1. 不能由单质直接化合而得到的化合物是 ( A )
A. FeCl2 B. Al2S3 C. CuCl2 D. MgO
2. 下列物质间发生化学反应,反应产物只能有一种的是 ( C )
A. C2H2+HCl B. CH4+Cl2 C. Al+O2 D. Fe+O2
3. 下列物质的分子式(或化学式)错误的是( A )
A. 重晶石 BaCO3 B. 绿矾 FeSO4·7H2O
C. 白磷 P4 D. 明矾 K2SO4·Al2(SO4)3·24H2O
4.在高温下,反应2HBr(g)![]() H2(g)+Br2(g)(正反应是吸热反应)达到平衡时,要使混合气体颜色加深,可采取的方法是
( C )
H2(g)+Br2(g)(正反应是吸热反应)达到平衡时,要使混合气体颜色加深,可采取的方法是
( C )
A. 增加氢气浓度 B. 减小压强
C. 缩小体积 D. 降低温度
5.把a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连,可以形成原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c极上产生大量气泡,b、d相连时,b极上有大量气泡。则四块金属的活动顺序是:( A )
A.a>c>d>b B.c>a>b>d
C. a>c>b>d D.c>a>d>b
6.把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是 ( B )
A. 自来水 B. 0.5 mol / L盐酸
C. 0.5 mol / L HAc溶液 D. 0.5 mol / L KCl溶液
7.下列块状金属在常温时能全部溶于足量浓HNO3的是 ( B )
A.Au B.Cu C.A1 D.Fe
8.下列物质中,能用浓盐酸鉴别的组别是 ( C )
A. 锌、铝、铜、铁
B. 氧化钠、碳酸钠、偏铝酸钠、硫酸钠
C. 炭黑、氧化铜、铁粉、硫化亚铁
D. 芒硝、碳铵、苏打、明矾
9.Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:
Fe2++2H2O![]() Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是 ( A )
Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是 ( A )
A. 平衡向逆反应方向移动 B. 平衡向正反应方向移动
C. 溶液颜色由浅绿色变为黄色 D. 溶液颜色由浅绿色变为深绿色
10.下列离子方程式正确的是 ( A )
A. 三氯化铁溶液中滴入氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3![]()
B. 苏打溶液中滴入少量稀盐酸:![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
C. 漂白粉溶液中通入少量CO2:ClO-+CO2+H2O=HClO+![]()
D.碳酸钡与稀硫酸反应:BaCO3+2H+=Ba2++CO2↑+H2O
二、选择题(本题包括14小题,每小题4分,共56分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分;但只要选错一个,该小题就为0分。)
11.下列说法正确的是 ( D )
A.原电池是把电能转化为化学能的装置
B.原电池中电子流出的一极是正极发生氧化反应
C.原电池的两极发生的反应均为氧化还原反应
D.形成原电池后,原电池中的阳离子向正极移动
12.有关铁与水反应的说法中,正确的是( D )
A.在任何条件下,铁与水均不发生反应。
B.在高温时,铁与水蒸气反应生成氢氧化铁和氢气。
C.在高温时,铁与水蒸气反应生成氧化铁和氢气。
D.在高温时,铁与水蒸气反应生成四氧化三铁和氢气
13.某溶液中有![]() 、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
( AC )
、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
( AC )
A. ![]() B. Mg2+
C. Fe2+ D.
Al3+
B. Mg2+
C. Fe2+ D.
Al3+
14.有100mL3mol·L-1NaOH溶液和100mL1mol·L-1AlCl3溶液,按如下两种方法进行实验: ①将NaOH溶液分多次加到AlCl3溶液中,②将AlCl3溶液分多次加到NaOH溶液中,比较两次实验的结果( D )
A.现象相同,沉淀量相等 B.现象相同,沉淀量不相等
C.现象不同,沉淀量不等 D.现象不同,沉淀量相等
15.将50 mL某未知浓度的AlCl3溶液分别加到60mL 1mol / L的NaOH溶液或60 mL 3mol / L的NaOH溶液中,均能得到1.56 g Al(OH)3沉淀。则此AlCl3溶液的浓度可能是( A )
A. 1 mol / L B. 0.5 mol / L C. 0.6 mol / L D. 0.4 mol / L
16.四位同学同时进行反应:A+3B=2C + 2D 的速率测定实验,分别测得反应速率如下:① v(A)= 0.15mol/(L.S);②v(B)= 0.6mol/(L.S);
③v(C)= 0.4mol/(L.S);④v(D)= 0.45mol/(L.S)。其中,反应进行得最快的是( D )A① B② C③ D ④
17.从化学反应速率和化学平衡两方面考虑,工业上合成氨应采用的条件是( D )
A.低温、高压、催化剂 B.低温、低压、催化剂
C.高温、高压、催化剂 D.适当温度、高压、催化剂
18.已知工业上真空炼铷的化学方程式为:
2RbCl+Mg![]() MgCl2+2Rb(g), 对于此反应,能够进行正确解释的是 ( B )
MgCl2+2Rb(g), 对于此反应,能够进行正确解释的是 ( B )
A. Rb比Mg金属性强
B. Rb比Mg沸点低,当把铷蒸气抽走时,平衡向正反应方向移动
C. MgCl2对热的稳定性比RbCl的弱
D. 高温下,Mg2+ 得电子的能力比Rb+ 弱
19.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是C
A. 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B. 同价态的阳离子,甲比乙的氧化性强
C. 甲能跟稀盐酸反应放出氢气而乙不能
D. 将甲、乙作电极组成原电池时,甲是正极
20.将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近于 ( A )
A. 2×10-10 mol/L B.
![]() (10-8+10-10)mol/L
(10-8+10-10)mol/L
C. (10-8+10-10)mol/L D. (1×10-14-5×10-5)mol/L
21.在pH=1的无色透明溶液中不能大量共存的离子组是( A )
A. Al3+、Ag+、![]() 、Cl-
B. Mg2+、
、Cl-
B. Mg2+、![]() 、
、![]() 、Cl-
、Cl-
C. Mg2+、K+、![]() 、Cl-
D. Zn2+、Na+、
、Cl-
D. Zn2+、Na+、![]() 、
、![]()
22.在调整好的天平左右两盘中各放一只质量相等的烧杯,两烧杯中均盛有1mol/L的稀H2SO4 100mL,然后分别向烧杯中加入一定量的Mg和Al,充分反应后,天平仍保持平衡,则镁、铝的量分别为:( D )
A.2.4克Mg、1.8克Al B.2.4克Mg、2.7克Al
C.0.99克Mg、0.99克Al D.5克Mg、5克Al
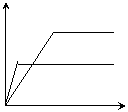
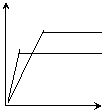 23对于可逆反应mA(固)+nB(气)
23对于可逆反应mA(固)+nB(气) ![]() eC(气)+fD(气),当其它条件不变时,C的体积分数与T(温度)和p(压强)的关系曲线如下图所示:对此下列叙述中正确的是( BD ) c% c%
p1
eC(气)+fD(气),当其它条件不变时,C的体积分数与T(温度)和p(压强)的关系曲线如下图所示:对此下列叙述中正确的是( BD ) c% c%
p1
|
T2
t t
A若使用催化剂,C的平衡含量将增大
B.升高温度化学平衡向逆反应方向移动
C、 方程式中,n>e+f
D.A的颗粒越小,越有利于平衡向正反应方向移动
24. 金属钾与金属钠的金属性相近,且钾比钠略强。当利用金属钾与钠盐共熔制取金属钠时,发现钾与钠的共熔体难以分离。若调整温度到一定程度,则可用金属钠与氯化钾反应,制取金属钾。下面是四种物质的熔点和沸点:C
K Na KCl NaCl
熔点℃ 63.65 97.8 770 801
沸点℃ 774 882.9 1500(升华) 1413
根据化学平衡移动原理可推知,用钠与氯化钾反应制取金属钾的适宜温度是
A. 97.8~770℃ B.770~774℃
C.801~882.9℃ [i]D.1413~1500℃
三、填空题(共40分,每空2分)
25、在一定条件下,可逆反应xA+yB![]() zC达到平衡。①已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是_____X+Y>Z___;②已知C是气体,并且x+y=z,在加压时化学平衡如发生移动,则平衡必定向__逆__方向移动;③已知B、C是气体,现增加A的物质的量(其它条件不变)平衡不移动,说明A是_固或液__态;④加热后,C的体积分数减小,则正反应是__放___热反应。
zC达到平衡。①已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是_____X+Y>Z___;②已知C是气体,并且x+y=z,在加压时化学平衡如发生移动,则平衡必定向__逆__方向移动;③已知B、C是气体,现增加A的物质的量(其它条件不变)平衡不移动,说明A是_固或液__态;④加热后,C的体积分数减小,则正反应是__放___热反应。
26. 实验室快速制取多量氨气常用浓氨水加热。当氨水较稀(质量分数低于20%),并且不用加热的条件下,如采用向氨水中添加适当的固体氯化铵和烧碱的措施,仍能快速制取多量的氨气,简述理由
氯化铵与氢氧化钠反应生成氮,而烧碱溶解于水是放热的产生的氨气多 写出有关反应方程式 NH4Cl+NaOH═NH3.H2O +NaCl
27、某工厂为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2
溶液,即可有效地除去Cl2,问这一处理过程中最终消耗的原料是 Fe
写出反应离子方程式(1) 2 Fe2++Cl2==2Fe3++2Cl--
(2) 2Fe3++Fe═3Fe2+
28.用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示。
| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.40 |
| 2 | 25.00 | 24.38 |
| 3 | 25.00 | 24.42 |
试回答下列问题:
(1)使用酚酞做指示剂,滴定终点的判断是 加最后一滴盐酸溶液高为无变
(2)若滴定管没有用标准酸液润洗,测定的NaOH的浓度将_偏高__
(填偏高、偏低、不变。下同)
(3)读标准酸液初始读数体积时仰视,测定的NaOH的浓度将_偏低_
(4)根据以上数据,未知浓度的NaOH溶液的物质的量浓度是 0.1288
mol/L
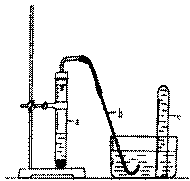 29. 用右图的简易装置可以进行气体
29. 用右图的简易装置可以进行气体
的发生和收集。
(1) 实验前应如何检查该装置的
气密性?
按图装配好把导管b放入水槽中,手握试管a观察导管b口是否有气泡产生,有气泡产生说明气密性良好
(2) 拔开试管 a的橡皮塞,加入10mL 6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速度缓慢,逐渐加快,请写出在试管a中所发生的所有反应的化学方程式
3Cu+8HNO3 ==3Cu(NO3)2+2NO+4H2O
(3)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出。试说明反应开始时,导管中水面先上升的原因:
试管中有少量空气开始生成的NO与氧气反应生成了NO2,二氧化氮与水反应生成NO体积缩小所以导管中水会上升,反应一段时间后氧气反应完,生成的NO气体从导管中逸出
30.有A.B.C.D.E五种化合物,其中A.B.C.D是铝元素的化合物。F是一种气体,标况下对空气的相对密度为1.103。有下列反应.
A + NaOH → D + H2O B ![]() A + H2O
A + H2O
C + NaOH(适量)→B + NaCl, E + H2O →NaOH + F。
则化学式分别为 A._Al2O3 B._Al(OH)3
C._AlCl3 D.__NaAO2_ E._Na2O2_
三、计算题(共24分,每题8分)
31、把0.69g Na投入500mL 0.1 mol/L的AlCl3溶液中,有0.78g白色沉淀生成,再投入多少克Na可使沉淀恰好完全溶解。
解:设需要投入的总的钠为X摩,根据方程式有下列关系:
4Na~~~~~~4NaOH~~~~AlCl3
4 4 1
X 0.5×0.1
X=0.2mol
需要再加入的金属钠的质量为0.2mol×23g/mol---0.69g=3.91g
答:略
32、铁粉和氧化铁粉末的混合物共48.8克, 加入到700毫升的稀硫酸中, 恰好完全反应, 得到氢气2.24升(标准状况)向反应后的溶液中滴入NH4SCN溶液, 搅拌均匀, 溶液未见红色, 也没固体残留。求:
(1)混合物中铁和氧化铁的质量?16.8g, 32g
(2)原稀硫酸的物质的量浓度?1mol/L
33、按物质的量比为1:4的N2、H2混合气体0.5mol在一定条件下于密闭容器中发生反应:N2+3H2![]() 2NH3。当反应达到平衡时容器内的压强为反应前的0.76倍。试求:
2NH3。当反应达到平衡时容器内的压强为反应前的0.76倍。试求:
(1)平衡混合气体中氨气的物质的量。0.12mol
(2)平衡时氮气的转化率。60%