高二第一学期化学期中考试3
I卷(选择题)
一、选择题(每小题只有一个选项符合题意)
1.下列化学药品中,可用铝槽车运输是的 ( )
A.浓HCl B.浓H3PO4 C.浓HNO3 D.稀HNO3
2.在C(S)+ CO2(g)![]() 2CO(g)(正反应为吸热反应)反应中,可使反应速率增大的措施是①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤减小压强 ( )
2CO(g)(正反应为吸热反应)反应中,可使反应速率增大的措施是①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤减小压强 ( )
A.①②③④ B.②③④ C.②③④⑤ D.①②③
3.四个不同的容器中,在不同的条件下进行合成氨的反应。根据下列在相同时间内测定的结果判断生成氨的速率最大的是 ( )
A.ν(H2)=0.1mol/(L·min) B.ν(N2)=0.1mol/(L·min)
C.ν(N2)=0.2mol/(L·min) D.ν(NH3)=0.3mol/(L·min)
4.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应
X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是:
( )
2Z(g),此反应达到平衡的标志是:
( )
A.容器内气体的总质量不随时间变化
B.容器内各物质的浓度是定值
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间内消耗0.1molX,同时生成0.2molZ
5.下列物质的水溶液能导电,但属于非电解质的是 ( )
A.酒精 B.Cl2 C.NH4HCO3 D.SO2
6.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是 ( )
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
7.下面的电离方程式正确的是 ( )
A.H2S![]() 2H++S2- B.HF
2H++S2- B.HF![]() H++F-
H++F-
C.NaHSO4![]() Na++HSO4- D.H2CO3
Na++HSO4- D.H2CO3![]() H++HCO3-
H++HCO3-
8.下列事实不能用勒夏特列原理解释的是 ( )
A.在硫酸工业中通入过量的空气提高SO2的转化率
B.约有85%的化学反应需要使用催化剂
C.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫
D.氯气难溶于饱和食盐水
二、选择题(每小题有1~2个正确选项)
9.下列图中表示2A(气)+B(气)![]() 2C(气)(正反应放热),这个可逆反应的正确图象为 ( )
2C(气)(正反应放热),这个可逆反应的正确图象为 ( )
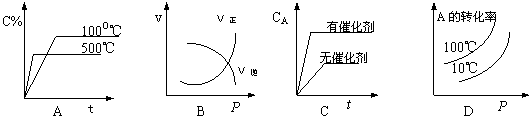
10.在密闭容器中进行如下反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能的是
( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能的是
( )
A.Z为0.3mol/L B.Y2为0.35mol/L
C.X2为0.2mol/L D.Z为0.4mol/L.
11.在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应2R(g)+5Q(g)![]() 4X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则反应方程式中的n值为
( )
4X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则反应方程式中的n值为
( )
A.2 B.3 C.4 D.5
12.a克金属铜与含b克硝酸的溶液恰好完全反应,若a∶b=4∶10.5,则反应中起酸性作用的硝酸质量为 ( )
A.63a/32 g B.b/4 g C.3a/4 g D.3b/4 g
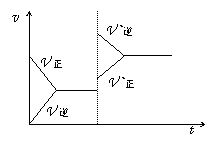 13.于可逆反应x+y
13.于可逆反应x+y![]() z+w达平衡后,在其他条件不变的情况下,增大压强,反应速率变化如右图。 ( )
z+w达平衡后,在其他条件不变的情况下,增大压强,反应速率变化如右图。 ( )
判断四种物质的状态正确的是
A.四种物质均为气体
B.x、y均为气体,z、w中有一种为气体
C.z、w中有一种为气体,x、y皆非气体
D.z、w均为气体,x、y中有一种为气体
14.定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3=HNO3+N2+N2O,在反应中被氧化与被还原的氮原子数之比为
( )
A. 5∶3
B. 5∶4 C. 1∶1
D. 3∶5
15.将2mol X,3mol
Z两种气体混合于某体积不变的密闭容器内发生如下反应:2X(g)+Y(g)![]() 3Z(g),平衡时,生成n mol Z,恒温条件下,按下列配比投入各物质,达到平衡时Z的物质的量大于n mol的是
( )
3Z(g),平衡时,生成n mol Z,恒温条件下,按下列配比投入各物质,达到平衡时Z的物质的量大于n mol的是
( )
A.3.2mol X,0.6mol Y,1.2mol Z B.3.6mol X,1mol Y,0.6mol Z
C.2.8mol X,0.4mol Y,1mol Z D.2.2mol X,0.2mol Y,2.4mol Z
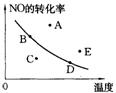 16.右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)
16.右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)![]() 2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且正反应速率大于逆反应速率的点是A
2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且正反应速率大于逆反应速率的点是A
A.C B.A或E C.B D.D
17.0.01mol/L的硫酸溶液中由水电离出来的H+浓度是
A.5×10-13mol/L B.0.02mol/L
C.1×10-7mol/L D.1×10-12mol/L
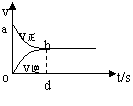 18.在容积固定的2L密闭容器中,充入X、Y各2mol,发生可逆反应:X(g)+2Y(g)
18.在容积固定的2L密闭容器中,充入X、Y各2mol,发生可逆反应:X(g)+2Y(g)![]() 2Z(g)并达到平衡,以Y浓度改变表示的反应速率V正 、V逆与时间的关系如图,则Y的平衡浓度表达式正确的是(式中S指对应的区域面积)
( )
2Z(g)并达到平衡,以Y浓度改变表示的反应速率V正 、V逆与时间的关系如图,则Y的平衡浓度表达式正确的是(式中S指对应的区域面积)
( )
A.2-Sabo B.1-Sabo C.2-Sabdo D.1-Sbod
II卷(非选择题)
 三、填空题
三、填空题
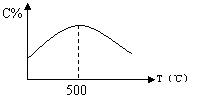
19.某可逆反应A(气)+3B(气)![]() 2C(气),开始均加入1mol A和3mol
B,在各种不同温度下,反应经过相同时间,测得C的百分含量c%与温度的关系如图所示:
2C(气),开始均加入1mol A和3mol
B,在各种不同温度下,反应经过相同时间,测得C的百分含量c%与温度的关系如图所示:
⑴该正反应是放热反应还是吸热反应 ;
⑵T>500℃时c%逐渐减小的原因是 。
20.在稀氨水中,分别加入下列各物质:A浓氨水、B纯水、C少量氢氧化钠固体、D少量浓H2SO4(填序号)
⑴ 能使C(OH-)减小,使C(NH4+)增大的是 ;
⑵ 能使C(OH-)增大,使C(NH4+)减小的是 ;
⑶ 能使C(OH-)和C(NH4+)都增大的是 ;
⑷ 能使C(OH-)和C(NH4+)都减小的是 。
21.一种蜡状固体在空气中完全燃烧生成白色粉末X,将X加入冷水中生成含氧酸Y,X加入热水中生成含氧酸Z。从以上实验结果可以判断此蜡状固体是 ,X是 ,Y是 。
22.某化学反应A(g)![]() 2B(g)(正反应吸热)在三种不同的条件下进行,B的起始浓度为0,反应物A的浓度随反应时间的变化情况如下表
2B(g)(正反应吸热)在三种不同的条件下进行,B的起始浓度为0,反应物A的浓度随反应时间的变化情况如下表
| 序 号 | 浓度/ 时间/S mol/L 温度/K | 0 | 20 | 40 | 60 |
80 | 100 |
| 1 | T1 | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
| 2 | T2 | c | 0.086 | 0.063 | 0.051 | 0.051 | 0.051 |
| 3 | T3 | 0.100 | 0.088 | 0.079 | 0.073 | 0.068 | 0.068 |

①实验1中,反应在20S—40S内的平均速率V(B)为 ,达到平衡时,A的转化率为 。
②实验1和2中温度相同,若均以A物质为准表示该反应的速度,则V1 V2;且
c 0.100mol/L(填“>”、“=”、“<”),理由是 。
③比较实验3和1 ,可推测T3 T1 (填“>”、“=”、“<”),理由是
。
④做第四组实验时,在与1相同的条件下,反应起始同时投入A和B,且B的浓度为0.04mol/L,达到平衡时,又测得A、B的浓度与实验1相同。则起始时,A的浓度为 mol/L。
 |
23.在如图所示的三个容积相同的容器中进行如下的反应:3A(g)+B(g)
(1)若起始温度相同,分别向三个容器中充入3molA和1molB,则达到平衡时各容器中C物质的百分含量由大到小的顺序为 ③②① (填容器编号)
(2)若维持温度不变,起始时②中投入3molA、1molB; ③中投入3molA、1molB和3molA、1molB则达到平衡时,两容器中B的转化率② ③(填<、>或=)
24.某温度(t℃)时,水的Kw=10-12,则该温度(填“>”、“<”或“=”) 25℃,其理由是 。
⑴将此温度下pH=11的NaOH与pH=1HCl等体积混合,混合后溶液pH= ;
⑵将此温度下pH=9的Ba(OH)2溶液取出1mL,加水稀释至500mL,则稀释后溶液中c(Ba2+)︰c(OH-)=
⑶将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。(1)若所得混合液为中性,则a︰b= 。(2)若所得混合液的pH=2,则a︰b= 。
******本题中均不考虑混合前后溶液体积的变化
四、计算题
25、Ⅰ、恒温、恒容下,在一个密闭的容器中发生如下反应:![]() A(g)+ B(g) 2C(g)
A(g)+ B(g) 2C(g)
(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为 mol;
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol;此时C的质量分数与(1)比较 (填相等、大于或小于);
(3)若开始时,放入x mol A,2 mol B和2 mol c到达平衡后,A和C的物质的量分别是y mol和3a mol,则x = mol, y = mol;开始时的反应将向 (选填一个编号)
(甲)正向移动 (乙)逆向移动
(丙)可能正向,可能逆向移动 (丁)平衡不移动
作出此判断的理由是 。
![]() Ⅱ、若在相同条件下的反应为:A(g)+ B(s)
2C(g),开始时加入1 mol A、1 mol B,反应达平衡时生成C为0.2
mol,则按下列配比加入后,达平衡时生成C的物质的量仍为0.2 mol的是
Ⅱ、若在相同条件下的反应为:A(g)+ B(s)
2C(g),开始时加入1 mol A、1 mol B,反应达平衡时生成C为0.2
mol,则按下列配比加入后,达平衡时生成C的物质的量仍为0.2 mol的是
A. 2 mol C B. 1 mol A + 0.5 mol B
C. 0.5 mol A + 0.5 mol B + 1 mol C D. 2 mol A + 2 mol B
26.合成氨工厂常通过测定反应前后混合气体的平均式量来确定氮的转化率。某工厂测得合成塔中N2、H2混合气体的平均式量为12.4,从合成塔中出来的混合气体在相同条件下平均式量为15.5。求该合成氨厂N2的转化率。
高二第一学期化学期中考试答卷
一~二
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | C | B | D | B | D | B | A | AB |
| AD题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 | A | AD | CD | A | B | A | D | B |
三、填空题
19.⑴ 放热反应 ;⑵ 550℃后达到平衡状态,温度升高,向逆方向移动 。
20.⑴ A ;⑵ B ;⑶ D ;⑷ E 。
21. 白磷 , P2O5 , HPO3 。
22.① 0.002mol/(LS) , 60% 。
② < ; > , 相同时间内 T2的反应速度快 。
③ < ,实验1和3的浓度相同,但是3的反应速度慢,说明3的温度比1来得低 。
④ 0.08mol/L 。
23.⑴ ③ ② ① ③②① ;⑵ >
24. > , 水的电离吸热,温度越高,电离程度越大,水的离子积常数越大 。
⑴ 6 ;⑵ 1:10 ;⑶① 1 。② 9:11 。
四、计算题
25、Ⅰ、⑴ 1-![]() _ ;⑵ 3a ; 相等 ;
_ ;⑵ 3a ; 相等 ;
⑶ 2 , 3(1-![]() ) ;丙
) ;丙
理由是 a的数值未知 。
Ⅱ、 A、B、C
26、解:
由混合气体的平均式量12.4,根据十字交叉法求出n (H2)/n(N2)=2:3
设共5moL气体,H2 2moL;N2 3 moL
由合成塔中出来气体的式量可知反应后总物质的量为4moL
![]() N2 + 3H2 2NH3 △n
N2 + 3H2 2NH3 △n
1 2
x 1
可知x=0.5moL 转化率为25%