高二第一学期期末考试化学试卷(化学班用)
第I卷(选择题 共46分)
可能用到的原子量:Fe-56 Mg-24 Al-27 Zn-65 Ba-137 S-32 C-12 O-16
Na-23 Cu-64 Cl-35.5 H-1
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
1、下列气体不能用浓硫酸干燥的是 (B)
A、CO2 B、H2S C、SO2 D、HCl
2、室温时,下列液体的密度比纯水密度大的是 (A)
A、硝基苯 B、浓氨水 C、乙醇 D、汽油
3、可以判断油脂皂化反应基本完成的现象是 (D)
A、反应液使红色石蕊试纸变蓝色 B、反应液使蓝色石蕊试纸变红色
C、反应后静置,反应液分为两层 D、反应后静置,反应液不分层
4、在C3H9N中,N原子以三个单键与其它原子相连接,它具有的同分异构体数目为 (D)
A、1 B、2 C、3 D、4
5、某种解热镇痛药的结构简式为
![]() OCOCH3
OCOCH3
COO NHCOCH2CH3
当它完全水解时,可得到的产物有 (C)
A、2种 B、3种 C、4 种 D、5种
6、把a g铁铝合金粉未溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉未的质量仍为a g,则原合金中铁的质量分数为 (A)
A、70% B、52.4% C、47.6% D、30%
二、选择题(本题包括7小题,每小题4分,共28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
7、第四周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是 (C D)
A、原子半径比钾的原子半径大 B、氯化物难溶于水
C、原子半径比镁的原子半径大 D、碳酸盐难溶于水
8、下列各组混合物不能用分液漏斗分离的是 (B D)
A、硝基苯和水 B、苯和甲苯
C、溴苯和氯化钠溶液 D、甘油和水
9、下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是 ( C)
A、Na+ Ba2+ Cl- SO42- B、H+ NH4+ Al3+ SO42—
C、K+ AlO2- NO3- OH- D、H+ Cl- CH3COO- NO3-
10、下列反应的离子方程式正确的是 (A)
A、氯化铁溶液中通入硫化氢气体
2Fe3+ + H2S = 2Fe2+ + 2H+ + S↓
B、向次氯酸钙溶液中通入二氧化硫
Ca2+ + 2ClO- + SO2 + H2O = CaSO3 ↓+ 2HClO
C、硫化亚铁中加入盐酸
S2- + 2H+ = H2S↑
D、钠和冷水反应
Na + 2H2O = Na+ + H2↑ +2OH-
11、 将一定质量的Mg、Zn、Al混合物与足量稀硫酸反应,生成H2 2.8L(标准状况),原混合物的质量可能是 (B)
A、2g B、4g C、8g D、10g
12、下列说法不正确的是 (A D)
A、硫是一种淡黄色的能溶于水的晶体
B、硫的化合物常存在于火山喷出的气体中和矿泉水里
C、硫与氧属于同一主族
D、硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
13、同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H6和C2H2的混合气体,两瓶内的气体一定具有相同的 (C)
A、质量 B、原子总数 C、碳原子数 D、密度
第一学期高二期末考试
化学试卷
第II卷(非选择题 共104分)
班级___________姓名____________学号_____________
三、本小题共3小题,30分。
14、(8分)
(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)
|
①Na2O:_4Na+O2=2Na2O__________________
②Na2O2:__2Na+O2 == Na2O2________________
(2)指出氧在下列各物质中的化合价:
Na2O2___-1___;Na2O___-2___
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式__4KO2+2CO2=2K2CO3+3O2_______
(4)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式: (2、2、1、1、2OH-)
□
□
![]() O2- + □H2O
= □H2O2 + □O2 +□
O2- + □H2O
= □H2O2 + □O2 +□
15、(10分)化合物BrFx与水按物质的量之比3∶5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气。
(1)BrFx中,x =_____3________
(2)该反应的化学方程式是:
3BrF3 + 5H2O=HBrO3+9HF+Br2+O2
(3)此反应中的氧化剂和还原剂各是什么?
氧化剂_________BrF3____ 还原剂____BrF3 H2O_____
16、(12分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答:
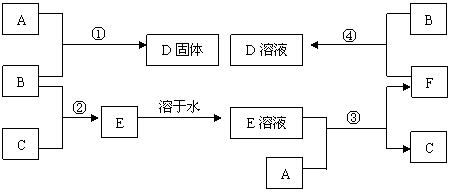
(1)A是____Fe______、B是___Cl2______、C是____H2____(请填化学式)。
(2)反应①的化学方程式为:___2Fe+3Cl2=2FeCl3___
(3)反应③的化学方程式为:____2HCl+Fe=FeCl2+H2______
(4)反应④的化学方程式为:____2FeCl2+Cl2=2FeCl3_____
四、本题共3小题,26分。
17、(7分)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式:__CO32- + H+ =H2O+CO2___
(2)这四种溶液分别是 甲:__氯化钙___乙:_碳酸钠 _
丙:__硝酸银____丁:_盐酸___。
18、(5分)镁铝合金溶于过量盐酸中,所得溶液中的阳离子为__Mg2+ Al3+ H+_____ ;加入过量氢氧化钠溶液后,溶液中减少的离子有_H+ Al3+ Mg2+___ ;增加的离子有____AlO2- OH-_;再加入过量盐酸后,减少的离子有 ___ AlO2- OH-_____, 增加的离子有____H+ Al3+ Mg2+_____。
19、(14分)长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量a g样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
④过滤,用蒸馏水洗涤沉淀。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤、⑥操作直到合格,最后得到b g固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?_________________不能_________。其理由是:____在酸性溶液中,NO3-能将SO32-氧化成SO42-,造成结果误差。
(2)步骤③中加盐酸使溶液呈强酸性的目的是:_保证得到的沉淀都是硫酸钡
(3)步骤⑦的“合格”标准是:__连续两次称量的质量不变
(4)实验测得样品中无水亚硫酸钠的质量分数是:(列出算式,不需化简)
(ag-142g/mol×bg÷233g/mol)÷ag×100%
五、(本题包括3小题,共25分)
20、(4分)某含氧有机化合物可以作为无铅汽油的抗爆震剂,它的分子量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。
CH3
![]()
![]()
![]()
![]() CH3 C O CH3
CH3 C O CH3
![]()
____________________CH3_________________________
![]() 21、(12分)今有化合物甲: O
乙: 丙:
21、(12分)今有化合物甲: O
乙: 丙:
![]()
![]() CCH3 CH3
CHO
CCH3 CH3
CHO
OH COOH CH2OH
(1)请写出丙中含氧官能团的名称:___醛基、羟基_______
(2)请判别上述哪些化合物互为同分异构体:___甲、乙、丙_______
(3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:___氯化铁溶液 显紫色__
________________________________________________________________
鉴别乙的方法:____碳酸钠溶液 生成气体__
_________________________________________________________________
鉴别丙的方法:____银氨溶液 生成银镜_____
_________________________________________________________________
(4)请按酸性由强至弱排列甲、乙、丙的顺序:____乙、甲、丙____
22、(9分)(1)今有A、B、C3种二甲苯;将它们分别进行一硝化反应,得到的产物分子式都是C8H9NO2,但A得到两种产物,B得到3种产物,C只得到一种产物。由此可以判断A、B、C各是下列哪一结构,请将字母填入结构式后面的括号中。
![]()
![]() CH3 CH3
CH3 CH3
![]() CH3
CH3
( C ) CH3 ( A ) CH3 ( B )
CH3
(2)请写出一个化合物的结构式。它的分子式也是C8H9NO2,分子中有苯环,苯环上有三个取代基,其中之一为羧基,但并非上述二甲苯的硝化产物。请任写一个:
![]() NH2
NH2
CH3 COOH
___________________________________________________________
六、(本题包括3小题,共23分)
23、(8分) 完全中和10.2g某二元酸H2A时,消耗了24g NaOH。求 [把答案填在横线上]
(1)10.2g该二元酸的物质的量是____0.3mol_____;
(2)该二元酸的摩尔质量是___34g/mol_____;
(3)A的相对原子质量是_____32_________;
已知A的原子核中质子数与中子数相等,A是___S______元素 。
24、(6分)在1.00 L 1.00 mol•L-1 NaOH溶液中通入16.8L标准状况下的CO2,计算所得溶液中含有的NaHCO3的物质的量为_0.5 0mol ___,
Na2CO3的物质的量为__0.25 mol _。[把答案填在横线上]
25、(9分)往400mL 0.5mol·L-1 NaOH溶液中通入一定量的H2S气体,然后在低温下蒸发溶液,得白色固体A 9.5g。
(1)推测白色固体A所有可能的组成,将其化学式填入下表。
| 编号 | 1 | 2 | 3 | 4 |
| A的组成 | NaOH Na2S | Na2S | Na2S NaHS | NaHS |
(2)通过计算确定A的组成及各物质的质量。
解: NaOH的物质的量为:0.400L ×0.5mol·L-1 = 0.2 mol
可生成Na2S的质量为:0.2 mol÷2×78g/mol=7.8g
可生成NaHS的质量为:0.2 mol×56g/mol=11.2 g
依题意得白色固体为9.5g,所以其组成为Na2S和 NaHS
设Na2S 和NaHS的物质的量分别为X、Y
列方程:2X+Y= 0.2
78X+56Y=9.5
解得:X=0.05 mol Y=0.1 mol
Na2S的质量为0.05 mol×78g/mol=3.9g
NaHS的质量为0.1 mol×56g/mol=5.6g