高二第一学期期末考试化学试卷(理科)
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108 C:12 O:16 S:32 Cl:35.5 Br:80
第Ⅰ卷(选择题 共44分)
一、选择题(本题包括22小题,每小题2分,共44分,每小题只有一个正确答案)
1.能实现氮的固定的是
A.工业上用氨和二氧化碳合成尿素 B.N2和H2在适当条件下合成氨
C.碳铵受热分解 D.氨被硫酸吸收
2.下列物质在常温下能起反应产生气体的是
A.铁跟浓硫酸 B.铝跟浓硫酸 C.铜跟稀盐酸 D.铜跟浓硝酸
3.用CO还原铁矿石(Fe2O3)炼铁,人们发现无论怎样改进设备,炼铁高炉所排出的高炉气中仍含有相当量的CO,其原因是
A.CO和铁矿石接触时间不够长 B.炼铁高炉不够高
C.铁矿石在高温下产生CO D.用CO还原铁矿石反应是一个可逆反应
4.将碳酸氢铵在试管中加热,使放出的气体依次通过盛有过氧化钠、浓硫酸的容器,最后得到的气体是
A.H2O B.CO2 C.O2 D.NH3
5.往淡绿色Fe(NO3)2溶液中逐滴加入稀盐酸时,溶液的颜色变化应该是
A.颜色变浅 B.逐渐加深 C.变棕黄色 D.没有变化
6.有两个学生在条件完全相同的情况下测定可逆A2+3B2![]() C2的化学反应速率,甲测得V(A2) =0.5mol/(L·min),乙测得V(B2)=1.5mol/(L·min),则这两个学生的测定结果
C2的化学反应速率,甲测得V(A2) =0.5mol/(L·min),乙测得V(B2)=1.5mol/(L·min),则这两个学生的测定结果
A.肯定都对 B.肯定都错 C.甲对乙错 D.都对或都错
7.下列各组离子,在强碱性溶液中都可以大量共存的
A.K+、Na+、HCO3-、Cl- B.Ba2+、Na+、AlO2-、NO3-
C.NH4+、Al3+、NO3-、Cl- D.Na+、Fe3+、Cl-、SO42-
8.下列关于硝酸的叙述正确的是
A.稀硝酸是弱酸,浓硝酸是强酸
B.铜与浓硝酸和稀硝酸都能反应生成二氧化氮
C.浓硝酸和稀硝酸都是强氧化剂
D.稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化
9.由铜、锌和稀硫酸组成的原电池,在工作过程中,电解质溶液的pH
A.不变 B.先变小后变大 C.逐渐变大 D.逐渐变小
10.向NaAlO2溶液中逐渐通入某气体,开始产生沉淀,继续通入气体时沉淀又溶解,该气体是
A.NO2 B.NO C.CO2 D.CO
11.下列各反应属于水解反应的是
A.H2O+H2O![]() H3O++OH-
B.NH3+H2O
H3O++OH-
B.NH3+H2O![]() NH3·H2O
NH3·H2O
C.HCO3-+H2O![]() H2CO3+OH- D.HCO3-
H2CO3+OH- D.HCO3-![]() H++CO32-
H++CO32-
12.反应X(g)+3Y(g)![]() 2Z(g)(正反应为放热反应),在不同温度、压强下(P1>P2)下,达到平衡时,混合物气体中Z的百分含量随温度的变化曲线为
2Z(g)(正反应为放热反应),在不同温度、压强下(P1>P2)下,达到平衡时,混合物气体中Z的百分含量随温度的变化曲线为
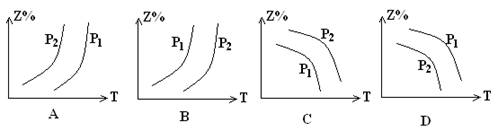
13.下列说法不正确的是
A.24K黄金比18K的黄金软 B.Al(OH)3在任何酸或碱的溶液里都溶解 C.酸性溶液不一定是酸的溶液 D.将锌铜平行插入稀硫酸中不能形成原电池
14.取两个半熟的番茄,相距一定距离,分别插入I、II、Ⅲ、Ⅳ四种导体,按右图用导线将导体与电流表相连后,能观察到电流表中指针偏转的导体组合是
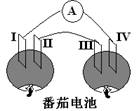
| 编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| A | Cu | Zn | Cu | Zn |
| B | Cu | Cu | Zn | Zn |
| C | Cu | Zn | Zn | Cu |
| D | Zn | Cu | Cu | Zn |
15.二战期间,丹麦物理学家玻尔把诺贝尔金质奖章溶解在一种溶液中,这种溶液是
A.浓H2SO4 B.浓HNO3 C.氯水 D.王水
16.在用酸滴定碱的实验中,若滴定前读酸式滴定管液面的读数是视线低于液体凹液面的最低处,滴定结束时读数正确,这样会使测得的碱的浓度
A.偏高 B.偏低 C.不受影响 D.不能确定
17.镁粉是焰火、焛光粉中不可缺少的原料,工业上制造镁粉需将镁蒸气在气体中冷却。下列气体可用于冷却镁蒸气的是
①空气 ②CO2 ③Ar ④H2 ⑤H2O
A.①② B.②③ C.③④ D.④⑤
18.在0.1mol/LCH3COONa 溶液中下列粒子浓度关系不正确的是
A.c(Na+)=c(CH3COO-)+c(CH3COOH) B.c(H+)+c(Na+)=c(CH3COO-)+c(OH-) C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.c(Na+)>c(OH-)=c(CH3COO-)>c(H+)
19.与盐酸或氢氧化钠都能反应的离子是
A.HCO3- B.Al3+ C.Fe3+ D.AlO2-
20.将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液,没有颜色变化,再加氯水显红色的是
A.Fe(OH)3 B.Fe2O3 C.FeO D. Fe3O4
21.将pH =3的H2SO4 和pH =12 NaOH溶液混合,当混合溶液pH =10时,强酸和强碱溶液的体积之比是
A.1:9 B.9:1 C.1:10 D.10:1
22.把10mL1.0mol/LAlCl3溶液与35mL1.0mol/L溶液混合、振荡,充分反应后所得沉淀的质量是
A.0.39g B.0.50g C.0.78g D.2.64g
高二第一学期期末考试
化学试卷(理科)
第I卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
全卷计分表
| 题号 | 一 | 二 | 三 | 总分 | 总分人 |
| 得分 |
第Ⅰ卷(非选择题 共56分)
二、填空题(本题共4个小题,共40分)
23.(10分)纯水是一种极弱的电解质,它能微弱地电离出________和___________,在25℃时纯水的pH=______________;在100℃时纯水的pH=6,此时纯水呈_______性,因为______________________________________。
24.(14分)根据右图转化关系回答问题:
(1)写出下列物质的化学式:
B________________、D________________
(2)写出下列转化的化学方程式:
B![]() NO:_________________________________________________________
NO:_________________________________________________________
D![]() E:___________________________________________________________
E:___________________________________________________________
⑶在通常情况下测得的相对分子质量比理论值_________________,原因是(用化学方程式表示)__________________________________________________。
25.(12分)某无色溶液里,含有下列八种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-、NO3-。已知该溶液能跟金属铝反应,且放出的气体只有氢气。试回答:
⑴若溶液跟铝反应只有AlO2-生成,则原溶液中一定含有的物质是(写化学式)_________,发生反应的离子方程式为_______________________________,还有可能大量含有的物质是____________________________。
⑵若溶液跟铝应后有Al3+生成,则原溶液一定大量含有的离子是___________________,一定不大量含有的离子是______________;
26.(4分)选用下列物质:石蕊试液、pH试纸、醋酸溶液、醋酸钠晶体、醋酸铵晶体(其溶液呈中性)、烧碱、蒸馏水,设计两种方案证明醋酸是一种弱电解质(要求回答实验步骤,所用试剂及产生现象)。
方案1:
方案2:
三、计算题(本题共2小题,每小题8分,共16分)
27.(8分)FeS能跟盐酸反应生成H2S气体和FeCl2.把8.8gFeS放入200mL2.0mol·L-1的盐酸中,制备H2S气体。完全反应后若溶液H2S的浓度为0.010mol·L-1,假定溶液的体积仍为200mL,试计算:
⑴收集到的H2S气体的体积(标准状况);
⑵所得溶液的(此时H2S的电离可忽略)。
{注:M(FeS)=88g/mol}
28.(8分)测血钙含量,可将2mL血液用蒸馏水稀释后,向其中加入足量的草酸铵晶体[化学式(NH4)2C2O4],反应生成CaC2O4沉淀:Ca2++C2O42-![]() CaC2O4;将沉淀用稀硫酸处理后得到H2C2O4:CaC2O4+H2SO4
CaC2O4;将沉淀用稀硫酸处理后得到H2C2O4:CaC2O4+H2SO4![]() CaSO4+H2C2O4;再用KMnO4溶液滴定,结果用去1.0×10-4·L-1的KMnO4溶液20.0mL。
CaSO4+H2C2O4;再用KMnO4溶液滴定,结果用去1.0×10-4·L-1的KMnO4溶液20.0mL。
⑴试配平H2C2O4与KMnO4在酸性溶液中反应的离子方程式。
____MnO4-+ H2C2O4+
H+![]() Mn2++ H2O+ CO2↑
Mn2++ H2O+ CO2↑
⑵计算血液中的含钙量(g/100mL)
高二第一学期期末考试
化学试卷(理科)参考答案与评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | B | D | D | C | C | D | B | C | C | A | C |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | D | B | A | D | B | C | D | A | C | B | A |
一、选择题(每小题2分,共44分)
二、填空题(共40分)
23.H+(2分) OH- (2分) 7(2分) 中 (2分) 溶液中c(H+)=c(OH-) (2分) 共10分
24.⑴B:NH3(3分) D:NO2(3分)
⑵B![]() NO:4NH3+5O2
NO:4NH3+5O2![]() 4NO+6H2O (2分)
4NO+6H2O (2分)
D![]() E:3NO2+H2O
E:3NO2+H2O![]() 2HNO3+NO (2分)
2HNO3+NO (2分)
⑶大(2分) 2NO2![]() N2O4(3分)
N2O4(3分)
25.⑴NaOH(2分) 2Al+2OH-+2H2O![]() 2AlO2-+3H2↑(2分) NaCl NaNO3(2分)
2AlO2-+3H2↑(2分) NaCl NaNO3(2分)
⑵H+、Cl-(2分) Ag+、HCO3-、OH-、NO3-(4分) 共12分
26.方案1:将少量醋酸钠晶体溶于适量蒸馏水中,用pH试纸测得其pH>7,则证明醋酸一种弱酸。(2分)
方案2:先用pH试纸测醋酸溶液pH值,然后向其中加入醋酸铵晶体,再用pH试纸混合溶液的pH值,后pH更大则证明醋酸是一种弱。(答入醋酸钠晶体也给分)(2分)
三、计算题(本题共2小题,每小题8分,共16分)
27.解:⑴FeS+2H+=Fe2++H2S↑
n(FeS)=8.8g÷88g·mol-1=0.1mol
n(H+)=0.2L×2.0mol·L-1=0.4mol>2n(FeS)
故FeS不足,H+过量 (2分)
n(总H2S)=n(FeS)=0.1mol
V(H2S)=(0.1mol-0.2L×0.010mol·L-1)×22.4L/mol=2.2L (2分)
⑵余(H+)=0.4mol-2L×0.1mol·L-1=0.2mol
c(H+)=0.2mol÷0.2L=1.0mol·L-1 (2分)
pH=-log{c(H+)}=0 (2分)
28.⑴2 5 6 2 8 10 (2分)
⑵n(Ca2+)=n(Ca2C2O4)=n(H2C2O4)=5/2 n(KMnO4)
故2mL血液中n(Ca2+)=2/5×1.0×10-4mol·L-1×20.0mL×10-3L/mL=5.0×10-6mol
即:c(Ca2+)=1×10-2g/100mL (4分)
⑶抽缩 (2分)