高二第一学期期末考试化学试卷
注意事项:(1)本卷共五大题。考试时间100分钟,满分100分,请将答案填写在答题卷上。
(2)本卷可能用到的数据是:H :1 O :16 C:12 Si:28 Mg:24 Al:27 Fe:56 Na:23 Cu:64
一、选择题(本大题包括25小题,每题只有一个选项正确,请将符合题意的选项填在答题卡上。每小题2分,共50分)
1、向下列溶液滴加稀硫酸,生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是( )
A Na2SiO3 B BaCl2 C FeCl3 D NaAlO2
2、只用一种试剂就能把AgNO3、KSCN、稀H2SO4、NaOH溶液区别,该试剂是( )
A、BaCl2溶液 B、FeCl2溶液 C、FeCl3溶液 D、Fe(NO3)3溶液
3、铁片投入下列溶液中反应后,金属片质量减少但无气体产生的是( )
A、冷稀HNO3 B、Cu(NO3)2溶液 C、稀H2SO4 D、Fe(NO3)3溶液
4、能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
(1)SCN-、(2)Fe、(3)Fe2+、(4)Cu、(5)H2S、(6)OH-
A、(1)(2)(3) B、(2)(4)(5) C、(1)(3)(6) D、(1)(2)(5)
5、a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知(1)a、c均能和稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱反应放出气体;(4)c、e在冷的浓硫酸中发生钝化。由此可判断a---e依此为( )
A、Fe、Cu、Al、Ag、Mg B、Al、Cu、Mg、Ag、Fe
C、Mg、Cu、Al、Ag、Fe D、Mg、Ag、Al、Cu、Fe
6、下列各组均为两瓶无标签的无色溶液,仅有试管和胶头滴管,不许使用其他任何试剂,也能鉴别的是( )
(1)NaOH和Al2(SO4)3(2)Na2CO3和盐酸;(3)Ba(OH)2和H3PO4;(4)HCl和NaAlO2
A (1)(2)(3) B (2)(3)(4) C (1)(4) D(1)(2)(3)(4)
7、甲、乙、丙、丁分别是Al2(SO4)3、、FeSO4、NaOH、BaCl2四种物质中的一种,若将甲溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A 、Al2(SO4)3 B、NaOH C、 BaCl2 D、FeSO4
8、把14ml 2mol/L的Al2(SO4)3溶液慢慢滴入30ml 6mol/L的NaOH溶液中,并不断搅拌,随Al2(SO4)3逐滴加入,所产生的现象是( )
A、白色沉淀-----沉淀增加
B、白色沉淀----沉淀增加----部分溶解
C、白色沉淀-----沉淀随即溶解-----澄清溶液
D、白色沉淀-----沉淀随即溶解-----不再溶解-----沉淀增加
9、向含有amol的AlCl3的溶液中加入含bmolKOH的溶液,生成沉淀的物质的量可能是( )
amol(2)bmol(3)a/3mol(4)b/3mol(5)0mol(6)(4a-b)mol
A、(1)(3)(4)(5)(6) B、(1)(2)(3)(4)(5)
C、(1)(4)(5)(6) D、(1)(4)(5)
10、某铁的氧化物,用7mol/L的盐酸100ml在一定条件下恰好完全反应,所得溶液再通入0.56L标况下的氯气时,刚好使溶液中的Fe2+完全转化为Fe3+。则该氧化物的化学式可表示为( )
A、FeO B、Fe3O4 C、Fe4O5 D、Fe5O7
11、将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A、3mol/LHCl B、4mol/LHNO3 C、8mol/LNaOH D、18mol/LH2SO4
12、将AlCl3溶液和NaAlO2溶液分别蒸干并灼烧,所得产物的主要成分是( )
A、均为Al(OH)3 B、前者得Al2O3后者得NaAlO2
C、均为Al2O3 D、前者得AlCl3,后者得NaAlO2
13下列物质发生反应的离子方程式正确的是( )
A、铁和三氯化铁溶液反应:Fe+Fe3+==2Fe2+
B、少量的氯气通入溴化亚铁溶液中:2Fe2++4Br-+3Cl2==2Fe3++2Br2+6Cl-
C、Fe(OH)3跟盐酸反应:Fe(OH)3+3H+==Fe3++3H2O
D、FeS跟稀硝酸反应:FeS+2H+==Fe2++H2S
14、向铁和Fe2O3的混合物中加入足量的稀盐酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4:1时,反应中的关系正确的是( )
被氧化的铁和被还原的铁离子物质的量之比为1:1
被氧化的铁和被还原的铁离子物质的量之比为2:1
被氧化的铁和被还原的铁离子物质的量之比为1:2
被氧化的铁和被还原的铁离子物质的量之比为1:3
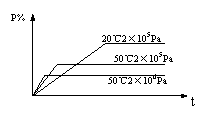 15、在密闭容器中进行如下可逆反应:M(g)+N(g)
15、在密闭容器中进行如下可逆反应:M(g)+N(g)![]() P(g)+2L,此反应变化规律符合右图图象。则下列结论中正确的是( )
P(g)+2L,此反应变化规律符合右图图象。则下列结论中正确的是( )
A、逆反应是放热反应,L为固体
B、正反应是放热反应,L为气体
C、逆反应是放热反应,L为气体
D、正反应是放热反应,L为固体或液体
16、右图是表示反应N2+3H2![]() 2NH3建立平衡的正逆速率变化过程,则下列能正确表示此过程的图象是(纵坐标表示物质的量浓度,横坐标表示时间)( )
2NH3建立平衡的正逆速率变化过程,则下列能正确表示此过程的图象是(纵坐标表示物质的量浓度,横坐标表示时间)( )
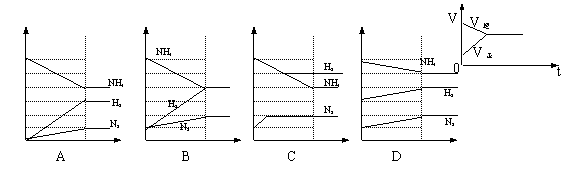 |
17、373K时,把0.5molN2O4气通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
前2秒,平均反应速率V(N2O4)=0.01mol/L/S
在2秒时体系的压强为开始时的1.1倍
在平衡时体系内含N2O40.25mol
平衡时,如果压缩容器体积,则可提高N2O4的转化率
18、用蒸馏水稀释0.1mol/L的HAc溶液到0.001mol/L,随溶液的稀释(T不变),下列各项中始终保持增大趋势的是( )
A、[CH3COOH] B、[H+]、[CH3COO-]
C、[H+]/[CH3COOH] D、[CH3COOH]/[CH3COO-]
19、下列溶液:①PH=0的盐酸;②0.1mol/L的NaOH溶液;③0.1mol/L的H2SO4溶液;④0.1mol/L的氨水溶液,由水电离出的H+浓度由大到小的顺序正确的是
A、①>③>④>② B、④>②>③>①
C、②>④>③>① D、③>④>①>②
20、在0.1mol/L的下列各溶液中NH4+的浓度由大到小的循序正确的是( )
NH4Cl、(2)NH4Ac、(3)(NH4)2SO4、(4)(NH4)2CO3、(5)NH4HSO4
A、(3)>(4)>(1)>(2)>(5) B、(4)>(3)>(5)>(1)>(2)
C、(3)>(4)>(5)>(1)>(2) D、(4)>(3)>(1)>(5)>(2)
21、下列有机物的命名中不正确的是( )
A、2––甲基丁烷 B、2—乙基戊烷
C、4—甲基—2––戊烯 D、3,3––二甲基–-1––戊烯
22、某有机物含碳40%、含氢为6.67%,0.2mol该有机物的质量为12g,则它的分子式为( )
A、C3H6O B、C2H4O2 C、CH2O D、C4H8O4
23、进行一氯取代后,只能生成三种沸点不同的一氯代烃的是( )
A、(CH3)2CHCH2CH2CH3 B、(CH3CH2)2CHCH3
C、(CH3)2CHCH(CH3)2 D、(CH3)3CCH2CH3
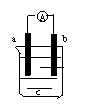
24、如图,电流计指针会偏转,一段时间后发现:a极变粗,b极变细,由此判断a,b,c可能是( )
| a | b |
| |
| A | Cu | Cu | CuSO4溶液 |
| B | Cu | Zn | 稀H2SO4 |
| C | Ag | Cu | AgNO3溶液 |
| D | C | Fe | Fe2(SO4)3溶液 |
25、电子表和电子计算器常用微型银––锌原电池作电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e![]() ZnO+H2O;Ag2O+H2O+2e
ZnO+H2O;Ag2O+H2O+2e![]() 2Ag+2OH-
2Ag+2OH-
总反应式为:Ag2O+Zn![]() 2Ag+ZnO。根据上述变化,下列判断正确的是( )
2Ag+ZnO。根据上述变化,下列判断正确的是( )
A、Zn是正极,Ag2O 是负极
B、工作时,电池负极区溶液pH值减小,正极区溶液pH值增大
C、工作时,电子由Ag2O极经过外电路流向Zn极
D、溶液中OH-向正极移动,K+,H+向负极移动。
二、填空题(本题包括4小题,其中26题6分,27题6分,28题13分,29题6分)
26、常温下,有PH为12的NaOH溶液100mL,若将其PH变为11(设溶液的体积可直接相加;计算结果保留到小数点后一位)
(1)若用PH=10的NaOH溶液,应加入 mL;
(2)若用PH=2的盐酸,应加入 mL;
(3)若用水稀释,则应加水 mL。
27、下列图中,横坐标为某溶液中加入某物质的量,纵坐标为生成沉淀的量,选择图中合适的序号填入下列各项中:
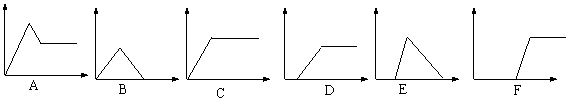 |
(1)饱和石灰中通入过量CO2______;(2)AlCl3溶液中通入过量的氨水__________
(3)含少量NaOH的NaAlO2溶液通入过量CO2_____;(4)含少量NaOH的NaAlO2溶液 中逐滴加稀盐酸________;(5)MgCl2、AlCl3溶液中逐滴加NaOH溶液至过量_______;
(6)NaOH溶液中逐滴加入AlCl3溶液至过量__________.
28、现有浓度各为1mol/L的FeCl3、FeCl2、CuCl2的混合液100ml,加入一定量的铁粉,按下列要求填空:
反应完毕铁有剩余:
反应完毕时,溶液中一定含有____________阳离子,是_________mol;一定没有_______阳离子。②固体物质烘干后,和反应前加入的铁粉质量相比__________( 填“增加”或“减少”)
反应完毕,有铜生成,铁粉无剩余:
反应后的溶液中一定含有___________阳离子,该阳离子在溶液中的物质的量的范围是________.②溶液中可能含有________阳离子,③溶液中一定不含___________阳离子④溶液的质量_______(填“增加”或“减少”)
(3)反应完毕后无固体沉淀物存在,反应后的溶液中一定存在________和_______阳离子。
29、已知T0C、PkPa时,在容积为VL的密闭容器内充有1molA和1molB。保持恒温恒压,使反应:A(气)+B(气)![]() C(气)达到平衡时,C的体积分数为40%。试回答有关问题:
C(气)达到平衡时,C的体积分数为40%。试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2molA和2molB,则反应达到平衡时,容器的容积为 ,C的体积分数为 。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T0C,使1molA和1molB反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为 。
三、实验题(本题共8分)
30、在如图的装置中,在A瓶中放入铁粉和稀硫酸,当反应开始后,再分别进行如下操作:
(1)若弹簧夹C打开,B容器中发生什么现象?
_______________________________________________
(2)若弹簧夹C关闭一会儿,容器A中的反应还在进行时,B
容器中有什么现象发生?
__________________________________________________
写出B容器中的有关化学反应方程式:
__________________________________________;____________________________________
(3)若先打开弹簧夹C一段时间,容器A中的反应还在进行时,再关闭弹簧夹C一会儿,B容器中有什么现象发生?_______________________________________________________
四、计算题(本题11分)
31、将14.6gNa,Al的混合物投入到足量的水中,使之完全反应,得一澄清溶液,同时收集到干燥,纯净气体1.0g。计算:
(1)原混合物中Na,Al的质量各为多少克?
(2)若在反应后的溶液中滴加1.0mol/L的HCl,当沉淀达到最大值时需要滴加HCl溶液多少毫升?
第一学期期末考试高二化学试卷 (答题卷) 班级_________,学号_______ ,姓名_________,得分________
一,选择题(每小题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | `13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
二、填空题(本大题包括4小题,其中26题6分,27题6分,28题13分,29题6分)
26、(1)___________;(2)____________;(3)____________
27、(1)_________; (2)____________: (3)____________
(4)___________: (5)_____________: (6)____________
28、(1)①_________, _________, __________ ② _________
(2)①__________, ________________________
②________ ③ ______ ④_____
(3) ___________,_____________
29、(1)__________, __________ (2) ____________
30、(1)______________________________________________
(2)_______________________________________________________________________
____________________________________;___________________________________
(3)_______________________________________________________________________
31、解:
32、(1)A点是___________________;B点是_______________
(2)硫酸的物质的量的浓度是_____________
(3)解:
参考答案
一,选择题(每小题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | `13 |
| 答案 | D | C | D | B | C | D | D | D | A | D | A | B | C |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | A | B | B | B | C | B | C | B | B | D | C | B |
二、填空题(本大题包括4小题,其中26题6分,27题6分,28题13分,29题6分)
26、(1)1000ml;(2)900/11ml;(3)900ml
27、(1)B; (2)C: (3)D
(4)E: (5)A: (6)F
28、(1)①Fe2+, 0.35, Fe3+ Cu2+ ② 减少
(2)①Fe2+, 大于0.25mol小于0.35mol ②Cu2+ ③ Fe3+ ④ 增大
(3) Fe2+, Cu2+
29、(1)10/7V, 40% (2) 5/7V
30、(1)有气泡冒出
(2)A容器中FeSO4溶液被压入到B容器中且产生沉淀,最后沉淀变为红褐色。
FeSO4+2NaOH![]() Fe(OH)2+Na2SO4;4Fe(OH)2+O2+2H2O
Fe(OH)2+Na2SO4;4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3
4Fe(OH)3
(3) A容器中FeSO4溶液被压入到B容器中且产生白色沉淀。
31、(1)WNa=9.2g WAl=5.4g
(2)VNaOH=400ml
 c
c