高二化学10月考
化学试题
第Ⅰ卷 (共52分)
一、选择题(每小题只有一个正确选项,每小题4分)
![]() 1.某温度下,反应2N2O5 4NO2
+ O2 开始进行时,N2O5的浓度为0.0408mol/L。经过 1min后N2O5的浓度变为0.030mol/L。则该反应的速率为 ( )
1.某温度下,反应2N2O5 4NO2
+ O2 开始进行时,N2O5的浓度为0.0408mol/L。经过 1min后N2O5的浓度变为0.030mol/L。则该反应的速率为 ( )
A、V(N2O5)=1.8×10-5 mol/(L·s) B、V(NO2)= 1.8×10-4 mol/(L·s)
C、V (O2)= 1.8×10- 4 mol/(L·s) D、V(NO2)= 2 V(N2O5)
![]() 2.在一定条件下,发生CO+NO2 CO2
+NO 的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法正确的是
( )
2.在一定条件下,发生CO+NO2 CO2
+NO 的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法正确的是
( )
A、正反应为吸热反应 B、正反应为放热反应
C、降温后CO的浓度增大 D、降温后各物质的浓度不变
![]() 3.在一定条件下,对于密闭容器中进行的反应 P(g)+Q
(g) R (g)
+ S (g) 下列说法中可以充分说明这一反应已达到化学平衡状态的是 ( )
3.在一定条件下,对于密闭容器中进行的反应 P(g)+Q
(g) R (g)
+ S (g) 下列说法中可以充分说明这一反应已达到化学平衡状态的是 ( )
A、P ,Q ,R ,S 的浓度相等 B、P ,Q ,R ,S 在密闭容器中共存
C、P ,Q ,R ,S 的浓度不再变化
D、用P的浓度表示的化学反应速率与用Q的浓度表示的化学反应速率相等
4.某温度下0.01mol/L的某一元弱酸PH为4,求该一元弱酸的电离程度 ( )
A、1﹪ B、2﹪ C、5﹪ D、 10﹪
5.若定义溶液的酸度
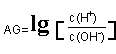 ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A、 25℃时,若溶液呈中性,PH=7 AG=1
B、 25℃时,若溶液呈酸性,PH﹤7 AG﹤0
C、 25℃时,若溶液呈碱性,PH﹥7 AG﹥0
D、25℃时,溶液的PH与AG的换算公式为AG=2(7- PH)
6.下列电离方程式中正确的是 ( )
A、 H2CO3 = 2H+ +CO32-
B、 HClO = H++ClO-
C、
![]() H2O+H2O H3O++ OH-
H2O+H2O H3O++ OH-
D、![]() NaOH Na++OH-
NaOH Na++OH-
7、甲乙两种溶液,PH都为2 。当取等体积的两溶液加水稀释后,根据PH的变化可以证明甲是强酸乙是弱酸,那么甲乙中加水的量是什么关系时方可证明 ( )
A、相等 B、甲﹥乙 C、甲﹤乙 D、不确定
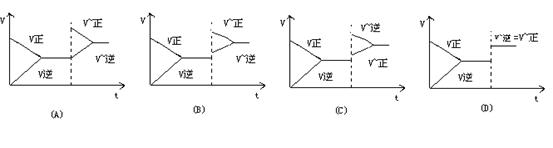
![]() 8.已知SO2催化氧化的反应为 2SO2 +
O2 2SO3(正反应放热 ) 当反应达到平衡后,升高温度,平衡发生移动,图中各图像中能正确描述正逆反应速率变化的是 ( )
8.已知SO2催化氧化的反应为 2SO2 +
O2 2SO3(正反应放热 ) 当反应达到平衡后,升高温度,平衡发生移动,图中各图像中能正确描述正逆反应速率变化的是 ( )
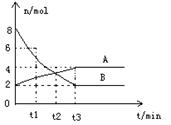 9.在一定温度下,使A和B发生反应并测得A、B的物质的量随反应时间的变化如图2曲线所示,下列表示中正确的是 ( )
9.在一定温度下,使A和B发生反应并测得A、B的物质的量随反应时间的变化如图2曲线所示,下列表示中正确的是 ( )
![]() A、该可逆反应的化学方程式为2A B
A、该可逆反应的化学方程式为2A B
B、t1时A的物质的量约为2.7mol
C、t2时正逆反应速率相等,可逆反应处于平衡状态
D、t3时正反应速率大于逆反应速率 图2
10.PH为2 的盐酸和PH为11的NaOH溶液恰好完全反应时,二者的体积比为( )
A、1 :1 B、 10 :1 C、1 :10 D、1 :100
![]() 11.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g) + 2 B(g) 2C(g)
反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等时A的转化率为( )
11.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g) + 2 B(g) 2C(g)
反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等时A的转化率为( )
A、40﹪ B、50﹪ C、60﹪ D、70﹪
12.C1,C2,а1,a2 ,PH1,PH2分别表示两种一元弱酸的物质的量浓度、电离程度和溶液的PH 。如果已知PH1﹤PH2,且а1﹥a2 ,则C1和C2的关系 ( )
A、C1﹥C2 B、C1=C2 C、C1﹤C2 D、无法确定
13.PH=5的盐酸用水稀释1000倍时,PH变为 ( )
A、 8 B、 9 C、约为7 D、 6
选择题答案填写在后面的答题卡中否则不计分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
第Ⅱ卷(48分)
14(9分)合成氨的反应N2+3H2 2NH3(正反应为放热反应)在某种条件下已达到平衡。
(1)若适当降低温度,平衡向 方向移动。
(2)若增大体系压强,平衡向 方向移动。这时逆反应的化学反应速率 。(选填“增大”、“不变”、或“减小”)
15.(6分)0.1mol/L的盐酸和0.1mol/L的醋酸溶液。比较二者的PH,较大的是
向0.1mol/L的氨水中加入少许NH4Cl晶体溶液中的氢氧根的浓度C(OH-) (选填“增大”、“不变”、或“减小”)
16.(4分)在某温度下有10ml 0.01mol/LFeCl3溶液中加入10ml 0.01mol/LKSCN溶液瞬间反应即达到平衡状态。
(1) 写出反应的离子方程式
(2) 保持温度不变,加入少量的KCl(s) ,则平衡( )
①、向正反应方向移动 ②、向逆反应方向移动 ③、先向正反应方向移动,后向逆反应方向移动 ④、先向逆反应方向移动,后向正反应方向移动 ⑤不移动
A、② B、②④ C、③ D、⑤
17.(8分)正误判断,正确的打“![]() ”错误的打“
”错误的打“![]() ”
”
(1)PH﹤7的溶液一定是酸性溶液( )
(2)PH=5的溶液和PH=3的溶液相比前者的C(OH-)是后者的100倍 ( )
(3)室温下,每1×107个水分子中只有一个水分子发生电离 ( )
(4)在1mol/L的氨水中,改变外界条件使C(NH4+)增大,则溶液的PH一定增大( )
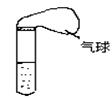 18.(6分)某学生课外活动小组利用右图装置做如下实验:
18.(6分)某学生课外活动小组利用右图装置做如下实验:
试管中盛的是较浓的氨水,氨水中因加有酚酞而显浅红色
(1) 对试管以热水浴的方式加热,观察到试管中的溶液
颜色变化是
(2) 将加热后的试管放入20℃的水中冷却,观察试管中的
溶液里有明显的现象,它是
二、计算(15分)
19.(7分)PH=10和PH=12的NaOH溶液等体积混合,求混合后溶液的PH?(已知lg2=0.3)
20.(8分)把3molA与2.5molB混合于2L密闭容器中,反应
![]() 3A(g)+2B(g)
xC(g)+2D(g) ,经5min后达到平衡生成1molD。测定5min内C平均反应速率为0.1mol/(L·min),求:
3A(g)+2B(g)
xC(g)+2D(g) ,经5min后达到平衡生成1molD。测定5min内C平均反应速率为0.1mol/(L·min),求:
(1) A的平均反应速率 (2) B的转化率 (3) X的值 (4) 反应前后压强之比。
答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| A | B | C | A | D | C | A | C | B | C | A | D | C |
14、正反应;正反应;增大
![]() 15、醋酸,减小
15、醋酸,减小
16、 Fe3+ + 3SCN- Fe(SCN)3 ;D
17、![]() ;
; ![]() ;
; ![]() ;
; ![]()
18、溶液颜色变浅;溶液颜色变深
19、PH=11.7
20、(1)0.15mol/L (2) 40% (3)X=2 (4)1.1倍