![]()
|
|
学科:化学 |
| 教学内容:电离平衡综合能力测试 |
【同步达纲练习】
一、选择题
1.在任何一种电解质溶液中,下列说法正确的是( )
A.阴、阳离子总数相等 B.阴、阳离子所带的电荷数相等
C.都存在未电离的溶质分子 D.溶液呈电中性
2.下列关于混合物,纯净物,强电解质,弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
| D | 重钙 | 普钙 | 氯化钠 | 次氯酸 | 氯气 |
3.确定酸溶液的酸性强弱的根据是( )
A.酸的强弱 B.酸分子中可电离出的H+个数
C.酸浓度 D.c(H+)
4.下列物质溶于水,由于水解而使溶液显酸性的是( )
A.P2O5 B.NaHSO4 C.CuCl2 D.NaF
5.在含有下列离子的各100ml溶液中,无论是加酸还是加碱(不考虑溶液体积变化),都能使这种离子浓度减小的是( )
A. ![]() B.
B.![]() C.
C.
![]() D.NH+4
D.NH+4
6.将①H+ ②Cl- ③Al3+ ④K+ ⑤O2-五种微粒分别加入水中,基本上不影响水的电离平衡的有( )
A.①②④⑤ B.②④⑤ C.①③⑤ D.②④
7.0.1mol/L的醋酸溶液加水稀释或加入少量醋酸钠晶体时,发生变化相同的是( )
A.醋酸的电离程度增大 B.溶液的导电性减弱
C.溶液中c(H+)增大 D.溶液的PH增大
8.物质的量浓度和体积均相同的下列各组物质的溶液混合后,PH大于7的是( )
A.NaCl、(NH4)2SO4、KNO3 B.Na2S、HCl、KCl
C.Ba(NO3)2、NH4Cl、Na2SO4 D.K2CO3、HNO3、HCl
9.有1支50ml的酸式滴定管,其中盛有0.1mol/L的盐酸溶液,液面恰好在15ml刻度处,若将试管内的酸溶全部放完刚好中和锥形瓶内35mlNaOH溶液,此碱液的物质的量浓度为( )
A.0.1mol/L B.小于0.1mol/L
C.大于0.1mol/L D.不能确定
10.将PH=2的X酸溶液和PH=12的Y碱溶液等体积混合,溶液的PH不小于7,则X、Y分别依次为( )
A.强酸、强碱 B.强酸、弱碱
C.弱碱、弱酸 D.弱酸、强碱
11.在[OH-]=1×10-14mol/L的无色透明溶液中,因发生氧化-还原反应而不能大量共存的离子组为( )
A.NH+4
S2- ![]() B.K+
B.K+ ![]() Cl-
Cl-
C.S2- ![]() Na+ D.Ca2+
Na+ D.Ca2+ ![]() NO-3
NO-3
12.在Na2S溶液中存在着多种离子,下列关系正确的是( )
A.c(OH-)=c(HS-)+c(H+)+c(H2S) B.c(OH-)=2c(HS-)+c(H+)+c(H2S)
C.c(OH-)=c(HS-)+c(H+)+2c(H2S) D.c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
二、填空题
1.二种钠盐,分别溶于水后,溶液PH均大于7,露置于空气中相当一段时间后(不考虑水分挥发),溶液的PH都近似为7,该两种溶液呈碱性的有关离子方程式为: ;
2.某盐的化学式为AxBOy,若A为+2价,B的化合价为 ,若此盐可完全电离,电离方程式为 ,若此盐为弱酸强碱盐,则水解离子方程式为(写第一步) .
3.60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
m-n 0 1 2 3
含氧酸强度 弱酸 中强 强 很强
实例 HClO H3PO4 HNO3 HClO4
试简要回答下列问题:
(1)按此规则H3AsO4、H2CrO4、HMnO4酸由强到弱的顺序为
(2)H3PO3和H3AsO4的形式一样,但酸的强弱相差很大已知H3PO4为中强酸,H3AsO4为弱酸,试推断H3PO3和H3AsO3的分子结构
(3)按此规则判断碳酸应属于 ,与通常认为的碳酸的强度是否一致? .其可能的原因
4.人体血液里Ca2+离子的浓度一般采用g/cm3表示.今抽一血样20.00ml,加过量的草酸铵[(NH4)2C2O4],溶液可析出草酸钙(CaC2O4)沉淀.将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用0.02mol/LKMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mlKMnO4溶液,试回答:
(1)滴定时,KMnO4溶液装在 滴定管中操作时,左手 ,右手 .
(2)草酸与KMnO4反应的离子方程式为:
5H2C2O4+2MnO4-+6H+=2Mnx++10CO2↑+8H2O
则式中x=
(3)滴定时,根据 现象,即可判断滴定终点.
(4)经过计算,血液样品中Ca2+的浓度为 g/cm3.

参考答案:
【同步达纲练习】
一、1.BD 2.B 3.D 4.C 5.C 6.D 7.D 8.B 9.C 10.AB 11.C 12.CD
二、1.ClO-+H2O![]() HClO+OH-
HClO+OH-
SO2-3+H2O![]() HSO-3+OH-
HSO-3+OH-
2.+(2y-2x) AxBOy=xA2++BOy2x- BOy2x-+H2O![]() HBOy(2x-1)-+OH-
HBOy(2x-1)-+OH-
3.(1)HMnO4>H2CrO4>H3AsO4
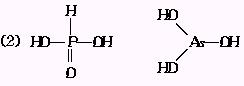
(3)中强酸;不一致;注于水中的CO2大部分没有转变为H2CO3
4.(1)酸式;控制活塞;摇动锥形瓶 (2)x=2 (3)溶液由无色变为紫红色 (4)0.012g/cm3
