高二第四章《几种重要的金属》测试题(40分钟)
有关原子量:C-12 H-1 O-16 N-14 S-32 Al-27 Mg-24 Fe-56 Cu-64 Na-23
一、选择题(每小题只有1个正确选项,每题4分,共52分)
1、下列叙述中,可以说明金属甲的活动性比金属乙强的是 ( )
A.反应中,甲原子失去电子比乙多 B. 同价态的阳离子,甲比乙的氧化性强 C. 与盐酸反应时甲放出的氢气比乙多 D. 将甲、乙做电极组成原电池时,甲是负极
2、下列物质在常温下混合后,明显有气体放出的是( )
A、铝与浓销酸 B、铝与稀硝酸 C、镁与烧碱溶液 D、铜与稀盐酸
3、将溶液中的Fe3+、Al3+分离,可选用的试剂是( )
A、氨水 B、NaOH溶液与盐酸 C、氨水和盐酸 D、NaOH溶液
4、工业上冶炼金属铝的方法是( )
A.热分解法 B.热还原法 C.电解法 D.电解精炼
5、用一种试剂就可以将NaOH、NH4SCN、AgNO3、Na2SO4四种无色溶液一一鉴别出来,这种试剂是( )
A、溴水 B、FeCl3 C、Fe(NO3)3 D、BaCl2
6、下列几种铁板,在镀层被破坏后,最耐腐蚀的是( )
A.镀锌铁板 B.镀铜铁板 C.镀锡铁板 D.镀铅铁板
7、向某溶液中投入铝片后有大量氢气放出,则溶液中一定能大量存在的离子是( )
A、K+、SO42- B、HCO3-、AlO2- C、Al3+、Cl- D、Na+、NO3-
8、向含1molKAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使溶液中的SO42- 恰好完全沉淀,则最后生成Al(OH)3的物质的量是( )
A、1mol B、1.33mol C、0.667mol D、0mol
9、将5.6g铁粉加入0.3mol硝酸铁的溶液中,充分反应后( )
A、Fe3+全部被还原 B、Fe3+部分被还原,Fe全部被氧化
C、Fe部分被氧化 D、溶液中只有Fe2+
10、下列实验装置中,一段时间后原电池正极会增重的是()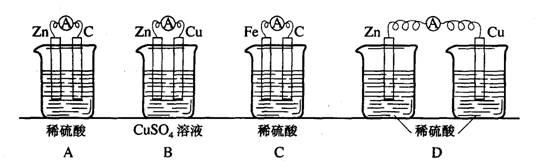
11、由Na、Mg、Al、Fe四种金属中的两种组成的混合物12g,与足量的盐酸反应产生氢气0.5g,则混合物中一定含有的金属是( )
A、Na B、Mg C、Al D、Fe
12、电子表和计算器的电源是微型银锌原电池,其电极材料分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn + 2OH- - 2e- = ZnO+ H2O, Ag2O+ H2O +2e- = 2Ag + 2OH-,下列说法不正确的是 ( )
A. Zn为正极,Ag2O为负极 B.电子由锌经外电路流入Ag2O极
C. Zn为负极,Ag2O为正极 D.工作一段时间后,Zn质量减少
13、在含有少量盐酸的AlCl3溶液中逐滴加入过量的氨水至溶液呈碱性,下列图中,能表示该反应产生的沉淀的质量W与加入氨水的何积V关系的是( )

二、推断题(共10分)
14、有A、B、C、D、E、F、G七种物质,它们的变化关系如下图所示:
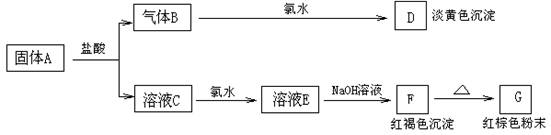
(1)写出下列物质化学式:A F G ;
(2)写出下列变化的化学方程式:
B→D: ; C→E: ;
三、填空题(共30分)
15、agMg在盛有bL(标况)CO2 和O2混合气的密闭容器中燃烧,反应结束后:(1)、若反应容器中的气体只有CO2,则容器内的固体一定含:______;(2)若反应容器中的气体中仍有O2剩余,则容器内的固体质量为:________g;(3)、若反应容器中无气体剩余,则容器内固体物质质量(m)的取值范围:______________________________。
16、把等物质的量的Cu、Fe投入一定量的FeCl3溶液中充分反应后,若溶液呈蓝色,加入KSCN溶液不显血红色,那么溶液里存在的金属离子有:______可能存在的金属粉末物质是:______。
17、铝片溶于热的烧碱溶液,反应的离子方程式为 ,该反应中氧化剂是 。向反应后的溶液逐滴加入稀盐酸,最初会产生白色沉淀,反应的离子方程为 。
18、炒过菜的铁锅末及时洗净(残液中含NaCl),第二天便会因被腐蚀而出现红棕色锈斑。试回答:(1)、铁锅的铁锈应属于_______腐蚀,腐蚀的原因是________(2)、铁锅腐蚀的电极反应式为:负极:____________正极:____________;正、负电极反应产物会继续发生反应,反应的离子方程式或化学方程式为____________________、_____________、______________.
高二第四章《几种重要的金属》测试题
答 卷
姓名:_____________学号:___________班级:__________成绩:___________
一、选择题:每空4分共52分。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
二、14、推断题:每空2分共10分
(1)、A_____________F___________G_____________
(2)B→D: ; C→E: ;
三、填空题:每空2分共30分。
15、(1)___________(2)_____________________(3)____________________________
16、____________________,________________________
17、________________________,___________________,_____________________________
18、(1)__________,___________________________________________________________
(2)_________,_________________;_________________________________________、
__________________________________、__________________________________________。
四、计算题(共8分)
19、(8分)将一定质量的CuO投入500ml0.1mol/L的盐酸中,待CuO溶解后,再投入过量的铁粉,充分反应后,得到氢气在标准状况下的体积为224ml,溶液中除尚余1.06g固体外全部是FeCl2,求投入CuO和铁粉各多少克?
解:
高二第四章《几种重要的金属》测试题
答 案
一、选择题:每空4分共52分。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| D | B | B | C | B | A | A | D | B | B | D | A | C |
二、14、推断题:每空2分共10分
(1)、A、FeS F、Fe(OH)3 G、Fe2O3
(2)B→D:H2S+Cl2=2HCl+S↓; C→E:3FeCl2+Cl2=2FeCl3 ;
三、填空题:每空2分共30分。
15、(1)MgO (2)5a/3 (3)(从产物分析:)a<m<(5a/3+15b/28);(质量守恒:)a<m<(a+44b/22.4)
16、Cu2+、Fe2+;Cu
17、2Al+2OH-+2H2O=2AlO2-+H2↑,H2O,AlO2-+H++H2O=Al(OH)3↓
18、(1)电化学;铁锅中的铁和少量碳及NaCl残液构成原电池,故发生电化学腐蚀。
(2)2Fe—4e- = 2Fe2+ , 2H2O+O2+4e- = 4OH- ;
Fe2+ +2 OH- = Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3、Fe(OH)3= Fe2O3+H2O
四、计算题(共8分)
19、(8分)将一定质量的CuO投入500ml0.1mol/L的盐酸中,待CuO溶解后,再投入过量的铁粉,充分反应后,得到氢气在标准状况下的体积为224ml,溶液中除尚余1.06g固体外全部是FeCl2,求投入CuO和铁粉各多少克?(1.2gCuO,1.5gFe)
解:设反应的铜物质的量是X。1.06g固体中是铜和过量的铁,H2的量是0.01mol=224/22.4×1000
Fe+2HCl=FeCl2+H2 Fe+CuCl2=Cu+FeCl2 Fe——FeCl2——2HCl
1 2 1 1 1 1 1 0.1×500×10-3
0.01 0.01 0.01 X X X
故:(0.01+X)2=0.1×500×10-3 X=0.015mol
m(CuO)=0.015×80=1.2g m(Cu)=0.015×64=0.96g
投入的铁粉:0.025×56+(1.06-0.96)=1.5g 答(略)
或:
Fe+2HCl=FeCl2+H2 Fe+CuCl2=Cu+FeCl2 CuO+2HCl=CuCl2+H2O
1 2 1 1 1 1 1 1 1 2
0.01 0.01 0.01 X X X X X
故有:2×0.01+2X=0.1×500×10-3 X=0.015mol
m(CuO)=0.015×80=1.2g m(Cu)=0.015×64=0.96g
投入的铁粉:0.025×56+(1.06-0.96)=1.5g 答(略)