高二第一学期(理化、生化班)化学期中试卷
第 Ⅰ 卷(选择题)
说明:本试卷分第I卷和第II卷,答题时将第I卷的选择题答案填入第II卷的相应空格内,交卷时只需交第II卷,并在第II卷相应位置填好班级、考号和姓名。
可能用到的相对原子质量:H: 1 N: 14 O: 16 S:32 Ba:137
一、选择题(本题共有10小题,每题只有一个正确答案)
1、在相同条件下,等质量(金属颗粒大小相当)的下列金属与足量1mol/L盐酸反应时,速率最快的是
A、镁 B、铝 C、锌 D、铁
2、把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g) ![]() H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是
H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是
A、HI的生成速率等于其分解速率
B、HI的生成速率小于其分解速率
C、HI的生成速率大于起分解速率
D、无法判断HI的生成速率和分解速率的相对大小
3、在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,则溶液颜色
A、变蓝色 B、变深 C、变浅 D、不变
4、下列液体pH>7的是
A、人体血液 B、蔗糖溶液 C、橙汁 D、胃液
5、设C+CO2![]() 2CO(正反应为吸热反应),反应速率为v1,N2+3H2
2CO(正反应为吸热反应),反应速率为v1,N2+3H2![]() 2NH3(正反应为放热反应),反应速率为v2。当温度升高时,上述反应的v1和v2的变化情况为
2NH3(正反应为放热反应),反应速率为v2。当温度升高时,上述反应的v1和v2的变化情况为
A、同时增大 B、同时减少 C、v1增大,v2减少 D、v1减少,v2增大
6、在一密闭容器中,等物质的量的A和B发生如下反应:A(g)+2B(g) ![]() 2C(g),一段时间后反应达到平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率是
2C(g),一段时间后反应达到平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率是
A、40% B、50% C、60% D、70%
7、镁和铝都是较活泼金属,下列叙述不正确的是
①镁易溶于冷水,而铝难溶于冷水 ②镁溶于碱液,而铝难溶于碱液 ③常温下镁难溶于浓硫酸,而铝易溶于浓硫酸
A、① B、② C、③ D、全部
8、把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生如下反应:
3 X (g)+Y (g) ![]() n Z (g)+2 W (g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.01mol/(L·min)。上述反应中Z气体的化学计量数n的值是
n Z (g)+2 W (g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.01mol/(L·min)。上述反应中Z气体的化学计量数n的值是
A、1 B、2 C、3 D、4
9、实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
A、K2SO4固体 B、NaOH溶液 C、(NH4)2SO4粉末 D、CH3COONa固体
10、物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3,按c(CO32-)由小到大排顺序正确的是
A、⑤<④<③<②<① B、③<⑤<②<④<①
C、③<②<⑤<④<① D、③<⑤<④<②<①
二、选择题(本题共有12小题,每题有一个或两个正确答案)
11、反应3Fe(s)+4H2O(g) ![]() Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A、增加Fe的物质的量
B、将容器的体积缩小一半
C、保持体积不变,充入Ne使体系压强增大
D、压强不变,充入Ne使容器的体积增大
12、对于相同物质的量浓度、相同体积的盐酸和醋酸,下列几种说法正确的是
A、它们的c(H+)不相同
B、各用水稀释一倍后,pH比较:盐酸<醋酸
C、分别和同浓度的氢氧化钠溶液反应至pH=7,所用氢氧化钠溶液的体积不同
D、各与足量的锌粒充分反应,产生H2的量不同
13、一定温度下,将a mol PCl5通入一个容积固定不变的密闭容器中,发生反应:
PCl5(g) ![]() PCl3(g)+Cl2(g),反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是
PCl3(g)+Cl2(g),反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是
A、2p1>p2 B、PCl5的分解率增大
C、p1>p2 D、Cl2的体积分数增大
14、能促进水的电离,并使溶液中的c(H+)<c(OH-)的操作是
A、向水中投入一小块金属钠 B、向水中加入NaOH固体
C、向水中加入CH3COONa固体 D、向水中加入NH4Cl固体
15、用来表示可逆反应2A(g)+B(g) ![]() 2C(g)(正反应是放热反应)的正确图象是
2C(g)(正反应是放热反应)的正确图象是
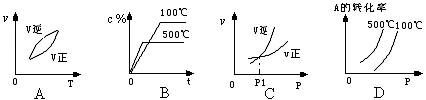
16、常温下某溶液中,水电离出的c(H+)=1×10-4mol/L,该溶液中的溶质可能是
A、Al2(SO4)3 B、CH3COONa C、NaOH D、NaHSO4
17、某温度下,在一容积可变的恒压反应容器中,反应2A(g)+B(g) ![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A、均减半 B、均加倍 C、均增加1mol D、均减少1mol
18、在室温下进行中和滴定,酸和碱恰好完全反应时以下说法一定正确的是
A、参加反应的酸和碱的物质的量相等
B、参加反应的酸中能电离出的H+总物质的量和碱中能电离出的OH-总物质的量相等
C、反应后溶液的pH=7
D、一定是一元强酸和一元强碱的相互反应
19、现有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.3mol/L,要使Mg2+转化Mg(OH)2,并使Mg2+与Al3+分离,至少需要4mol/LNaOH溶液的体积为
A、140mL B、120mL C、100mL D、80mL
20、将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A、c(HCN)<c(CN-) B、c(Na+)>c(CN-)
C、c(HCN)-c(CN-)=c(OH-) D、c(HCN)+c(CN-)=0.1mol/L
21、将0.1mol/L的CH3COONa溶液20mL与0.1mol/LHCl溶液10mL混合后,溶液显酸性,则溶液中有关粒子浓度关系正确的是
A、c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C、c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D、c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
22、100℃时水的离子积Kw=1×10-12。这时将等体积硫酸和氢氧化钠溶液混合,若溶液混合后显中性,则混合前硫酸的pH和氢氧化钠溶液的pH之和为
A、12 B、14 C、13 D、15
23、弱电解质的电离存在着电离平衡,当达到电离平衡时,已电离的分子数占弱电解质总分子数的百分比称为电离度。在25℃时,pH=4的盐酸和氯化铵溶液中,水的离子积(Kw)和电离度(HCl和NH4Cl分别用αA和αB表示)的叙述正确的是
A、Kw相等,αB ==αA B、Kw不等,αB ==11αA
C、Kw相等,αB ==![]() αA D、Kw相等,αB ==
αA D、Kw相等,αB ==![]() αA
αA
24、在容积一定的密闭容器中,可逆反应A2(g)+
B2(g)![]() xC(g)
符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)
符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3<P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
 第一学期
第一学期
高二(理化、生化班)化学期中试卷
第 II 卷(非选择题)
选择题答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
| 题号 |
|
|
|
|
|
|
|
|
|
|
|
|
| 答案 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
三、填空题(本题共有4小题)
25、用中和滴定法测定某烧碱的纯度。
⑴配制待测液:将1.7g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所用的主要仪器有________________________________________。
⑵滴定:①盛装0.20mol/L盐酸标准液应该用_______式滴定管,滴定管洗涤干净的标准是________________________________________________________________________。
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视__________________,滴定终点时,锥形瓶中的溶液的颜色变化是(选序号)_________。
A、由黄色变为红色 B、由黄色变为橙色 C、由浅红色变为无色 D、由无色变为红色
③有关数据记录如下:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
⑶纯度计算:
NaOH溶液的浓度为______________mol/L,烧碱样品的纯度为____________。
⑷对几种假定情况的讨论:(填无影响、偏高、偏低)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果_________________。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果_________。
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果_________。
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果_________________。
26、一定条件下,可逆反应A2+B2![]() 2C达到平衡后,c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、gmol/L。请确定:
2C达到平衡后,c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、gmol/L。请确定:
⑴a、b应满足的关系式__________________。
⑵若反应从正反应方向开始进行,当g=____________时,a有最大值为__________。
⑶若反应从逆反应方向开始进行,当b=____________时,a有最小值为__________。
⑷综合⑵、⑶的结论,可知本题中a的取值范围为____________________________。
27、(用化学式填空)在空气中:将氯化铁溶液蒸干并灼烧得到的固体物质____________;碳酸氢钠溶液蒸干得到的固体物质_____________;硫酸铝溶液蒸干得到的固体物质_____________;亚硫酸钠溶液蒸干得到的固体物质__________。
28、有pH=12的NaOH溶液100mL。如果将其pH降为11,那么:(设两溶液混合后的体积等于混合前各体积之和)
⑴若用蒸馏水应加入______________mL ⑵若用pH=10的NaOH溶液应加入_____________mL ⑶若用pH=2的盐酸溶液应加入_____________mL ⑷若用浓度小于0.01mol/L的醋酸应加入的体积范围是________________。
四、计算题(本题共有2小题)
29、50mL0.1mol/LBaCl2与100mL0.75mol/L H2SO4溶液混合,求:
⑴产生沉淀多少克?
⑵反应后溶液的pH为多少?
30、在温度为373K时,把11.5g N2O4气体通入体积为500ml的真空密闭容器中立即出现红棕色,反应进行到2s时,NO2含量为0.01mol,进行到60s时,达到平衡,此时容器中混合气体的密度是氢气密度的28.75倍,则:
⑴开始时2s内以c(N2O4)的变化表示的反应速率是多少?
⑵达到平衡时体系内的压强是开始的多少倍?
命题、校对:高二备课组 责审:李建冰 审定:教务处
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | A | B | C | A | A | A | D | A | D | B | AC | CD |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 答案 | A | AC | AB | AB | C | B | D | BD | BD | A | D | D |
三、25 (1)天平、烧杯、200mL容量瓶、玻璃棒、药匙、滴管
(2)酸 滴定管内壁上的水均匀了,既不聚成水滴也不成股流下 锥形瓶内溶液的颜色变化 C
(3)0.20 94.6%
(4)无影响 偏高 偏低 偏低
26、(1) a-b=0.4 (2) 0 1.3 (3) 0 0.4 (4) 0.4≤a≤1.3
27、Fe2O3 Na2CO3 Al2(SO4)3 Na2SO4
28、900 1000 81.8 81.8<V<900
29、解:
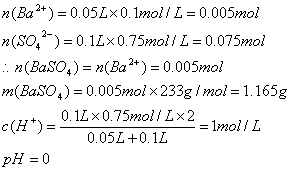
答:略
30、解:(1) N2O4 ====== 2NO2
开始 0.125mol 0
2s转化 0.005mol ![]() 0.01mol
0.01mol
v(N2O4)=![]()
(2)平衡时平均相对分子质量为:2×28.75=57.5
NO2 46 34.5
57.5
![]()
N2O4 92 11.5
设平衡时转化了N2O4物质的量为xmol
则有:
N2O4 ====== 2NO2
开始 0.125mol 0
转化 xmol ![]() 2xmol
2xmol
平衡 (0.125-x)mol 2xmol
![]() x=0.075mol
x=0.075mol
即平衡时气体总物质的量:0.125mol+xmol=0.2mol
![]()
答:略