科目:化学 模块:物质结构与性质
注意事项:
1. 用蓝色或黑色钢笔或圆珠笔将答案答在试题卷上。
2. 可能用到的相对原子质量:
H 1 Li 7 O 16 S 32
第一题(本大题共6小题,满分42分)。
1、(18分)下表列出了A~R九种元素在周期表中的位置:
| 主族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 周期 | ||||||||
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(1)这九种元素分别为(用元素符号表示)A______、B______、C______、D______、E______、F______、G______、H______、R______,其中化学性质最不活泼的是______;
(2) A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是__________;
(3) A、B、C三种元素按原子半径由大到小的顺序排列为_________________________;
(4)F元素氢化物的化学式是__________,该氢化物在常温下跟A发生反应的化学方程式是_________________________________________________,所得溶液的pH______7;
(5)H元素跟A元素形成化合物的化学式是_________,电子式为__________________;
(6)G元素和H元素两者核电荷数之差是____________。
2、(4分)在下列化学反应中:
①2Na2O2 + 2H2O === 4NaOH + O2 ↑
②CaO + H2O === Ca(OH)2
③Mg3N2 + 6H2O === Mg(OH)2 ↓+ 2NH3↑
④NH4C1 + NaOH === NaCl + H2O + NH3 ↑
既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是_____。
3、(4分)氢化物①HF、②H2O、③NH3、④CH4在液态时,分子间不存在氢键的是_________。
4、(4分)冰醋酸熔化时,需克服的微粒间相互作用力是__________;碘升华时,需克服的微粒间相互作用力是__________;硫酸钠溶解时,需克服的微粒间相互作用力是__________;二氧化硅冶炼硅时,二氧化硅需克服的微粒间相互作用力是__________。
5、(6分)BBr3的熔点是-46℃,SiC的熔点是2700℃。根据熔点分析,BBr3可能属于________
晶体,SiC可能属于_________晶体。BN(氮化硼)和CO2分子中的化学键均为共价键,BN的熔点高且硬度大,而CO2的晶体干冰却松软而且极易升华。由此可判断,BN可能是______晶体,而CO2是______晶体。CO2晶体中的分子在堆积排列时采取紧密堆积的方式,结构型式为______________。
6、(6分)化合物YX2、ZX2中,X、Y、Z都是前三周期的元素,X与Y属于同一周期,Z是X的同族元素,Z元素核内有16个质子。Y元素最外层电子数是K层所能容纳的电子数的2倍,则YX2为_________物质和ZX2为___________物质(填化学式)。
第二题(本大题共3小题,满分18分)。
7、(6分)写出下列相关元素的名称及其核外电子排布式。
(1)原子中2p轨道半充满的元素;
元素名称________,核外电子排布式_______________________________________。
(2)原子中3d、4s轨道均为半充满的元素。
元素名称________,核外电子排布式_______________________________________。
8、(8分)已知某元素的原子序数是29,该元素处在_____周期,_______族,是_________元素(填金属或非金属),该元素的最高化合价是_________。请用四个量子数描述该元素4s上的电子 。
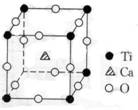 9、(4分)许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视做由若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为___________
9、(4分)许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视做由若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为___________
第三题(本大题共1小题,满分6分)。
10、(6分)已知白磷与氧气反应得到的P2O3和P2O5分子实际上是P4O6和P4O10分子。请你根据白磷的分子结构画出P4O6和P4O10的分子构型。
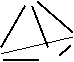 P
P
P
P P
第四题(本大题共2小题,满分20分)。
11、(9分)不同元素的原子在分子内吸收电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的X值:
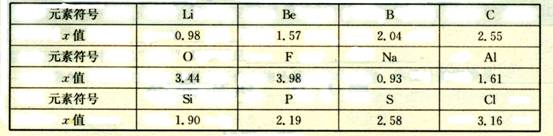
(1)通过分析x值变化规律,确定N、Mg的x值范围:
_____< x (Mg) <_____,_____< x (N) <_____。
(2)推测x值与原子半径的关系是_________________________________。根据同周期元素x值的变化特点,体现了元素性质的____________________________________变化规律。
(3)经验规律告诉我们:当成键的两原子相应元素的x差值Δx > 1.7时。一般为离子键;Δx < 1.7,一般为共价键。试推断:AlBr3中化学键类型是_____________。
(4)化合物NH3与BF3可以形成NH3·BF3。在NH3·BF3中,______元素的原子提供孤对电子,________元素的原子接受孤对电子。
![]() 12、(11分)下列物质结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:
12、(11分)下列物质结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:
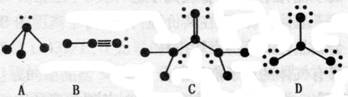
(1)根据各图表示的结构特点,写出该分子的化学式:
A_______________,B______________,C_______________,D____________。
(2)根据各图表示的结构特点,判断A“中心原子”是以______杂化轨道成键的;B“中心原子”是以______杂化轨道成键的;D分子中的“中心原子”是以______杂化轨道成键的。
(3)根据各图表示的结构特点,判断A、B、D分子中属于极性分子的是______________
___________________;属于非极性分子的是________________________。(填分子式)
第五题(本大题共2小题,满分14分)。
13、(6分)元素X和Y属于同一个主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和 60%。X、Y形成的两种化合物的化学式
①___________②_________。
14、(8分)右图所示为Li2S的晶胞,晶胞的边长为5.88×10-10m。
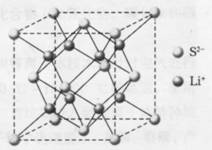 (1)在一个Li2S晶胞中存在________个Li+ 和
(1)在一个Li2S晶胞中存在________个Li+ 和
_____个S2-。
(2)通过计算说明Li2S晶体的密度为多大。