高中化学第四学期末教学质量加试
化 学
(满分50分,时间60分钟)
有关相对原子质量:H—1 C—12 N—14 O—16 Cl—35.5 Na—23 K—39
一、选择题:请将选出的正确答案填涂在答题卡上。每题只有一个选项符合题意。共24分
1.下列分子中,所有原子不可能共处在同一平面上的是
A.C2H2 B.C2H4 C.CH4 D.C6H6
2.在下列有关晶体的叙述中错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.稀有气体的原子能形成分子晶体 D.金属晶体的熔沸点均很高
3.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在lnm~100nm之间
B.能透过半透膜
C.能发生电泳现象
D.加热蒸干、灼烧后都有氧化铁生成
4.amLA、B、C三种气态混合物与足量O2混合点燃后,恢复到原状态(常温、常压),体积变小了2amL,则A、B、C三种烃可能是
A.CH4、C2H4、C3H6 B.CH4、C2H2、C2H4
C.CH4、C2H4、C3H4 D.C2H6、C3H6、C4H6
5.婴儿用的一次性尿片中有一层能吸水保水的物质。下列高分子中有可能被采用的是
![]()
![]()
![]()
![]()
![]()
![]() A.[
A.[![]() CH2-CH-]n
CH2-CH-]n![]()
![]() B.[CH2-CH-]n
B.[CH2-CH-]n
F OH
![]()
![]()
![]()
![]()
![]() C.[CCl2-CCl2]n D.[CH2-CH]n
C.[CCl2-CCl2]n D.[CH2-CH]n
OOCCH3
6.可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
A.氯化铁溶液、溴水 B.碳酸钠溶液、溴水
C.酸性高锰酸钾溶液、溴水 D.酸性高锰酸钾溶液、氯化铁溶液
7.A、B两种有机物的最简式均为CH2O,关于它们的下列叙述中,正确的是
A.它们相互为同系物
B.它们互为同分异构体
C.它们燃烧后产生的CO2和H2O的物质的量之比为1:1
D.取等物质的量的A、B,完全燃烧后所消耗的O2的物质的量相同
8.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是
OH OH OH
A.CH3-CH-CH2-CHO B.CH3-CH-CH-CH3
O
‖
C.CH3-CH===CH-CHO D.HOCH2-C-CH2-CHO
9.把盛有淀粉糊、淀粉酶的混合物的半透膜袋浸于37℃的水中,过一段时间后取温水分别实验,其现象正确的是
A.加碘水变蓝
B.加入浓硝酸微热,有黄色沉淀生成
C.加银氨溶液并水浴加热后无银镜产生
D.加新制Cu(OH)2加热煮沸有红色沉淀生成
10.若溶液中由水电离产生的c(OH-)==1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
11.已知在1×105Pa,298k条件下,2mol氢气燃烧生成水蒸气放出484KJ热量,下列热化学方程式正确的是
A.H2O(g)===H2(g)+O2(g) △H===+242KJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) △H===-484KJ·mol-1
C.H2(g)+O2(g)===H2O(g) △H===+242KJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) △H=+484KJ·mol-1
12.根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O===2HI+H2SO4 2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3===2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
二、(6分)13.KClO3与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可表述为:
![]() 口KClO3+口HCl(浓)→口KCl+口ClO2↑+口Cl2↑+口
口KClO3+口HCl(浓)→口KCl+口ClO2↑+口Cl2↑+口
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)。
(2)浓盐酸在反应中显示出来的性质是_________(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为________mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的__________倍。
O
‖
三、(4分)14.(1)1mol丙酮酸(CH3—C—COOH)在镍催化剂作用
下加1mol氢气转变成乳酸,乳酸的结构简式是______________________________。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是____________________________。
(3)B的甲酯可以聚合,聚合物的结构简式是________________________________。
四、(6分)15.某芳香化合物A的分子式为C7H6O2,溶于NaHCO3水溶液,将此溶液加热,能用石蕊试纸检验出有酸性气体产生。
(1)写出化谷物A的结构简式________________________________。
(2)依题意写出化学反应方程式 _________________________________________。
(3)A有几个属于芳香族化合物的同分异构体,写出它们的结构简式。
_____________________________________________________________________。
五、(10分)16.科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学和医学奖。请回答下列问题:
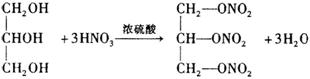
(1)已知M的分子量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是________________。D是双原子分子,分子量为30,则D的分子式为_________________。
(2)油脂A经下列途径可以得到M。
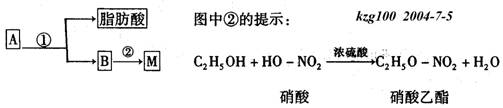
反应①的化学方程式是
_____________________________________________________________。
反应②的化学方程式是
_________________________________________________________________。
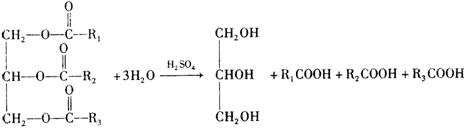
(3)C是B和乙酸在一定条件下反应生成的化合物,分子量为134,写出C所有可能的结构简式。
________________________________________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗_____________g金属钠。
第四学期末教学质量加试
化学参考答案
一、
1.D 2.D 3.D 4.C 5.B 6.C 7.C 8.A 9.D 10.B 11.A 12..A
二、
13.(1) 2,4,2,2,1,2 H2O (2) ② (3) 0.2 (4)2.63
三、
14.(1)CH3CH(OH)COOH
![]()
(2)CH2(OH)CH2COOH CH2=CHCOOH+H2O
![]()
![]()
![]() (3) [CH2-CH]n
(3) [CH2-CH]n
COOCH3
![]() 四、
四、
15.(1) —COOH
(2)
—COOH + NaHCO3![]() —COONa + CO2↑+ H2O
—COONa + CO2↑+ H2O
![]() OH
OH
—OH
![]()
![]()
![]()
![]() (3)
—CHO
—CHO HO— —CHO HCOO—
(3)
—CHO
—CHO HO— —CHO HCOO—
五、
16.(1)C3H5N3O9 NO
(2)
![]() (3) CH2OOCCH3
CH2OH (4)6.9
(3) CH2OOCCH3
CH2OH (4)6.9
![]()
CHOH CHOOCCH3
![]()
![]()
CH2OH CH2OH