普通高中毕业会考化学卷
化 学
本试卷包括第I卷、第Ⅱ卷。满分100分,考试时间90分钟。
第 I 卷(共50分)
可能用到的相对原子质量:H-1C-12N-14O-16 Na-23 Al-27 S-32 Cl-35.5 K-39 Ag-108 Ba-137 一、选择题(每小题只有一个选项符合题意。每小题2分,共50分)
1.下列各种气体中,通常状况下极易溶于水的是( )
A.Cl2 B.N2 C.NH3 D.C2H2
2.下列气态氢化物中,最稳定的是( )
A.HF B.HCl C.HBr D.HI
3.通常浓硫酸不具有的性质是( )
A.吸水性 B.脱水性 C.氧化性 D.挥发性
4.下列元素中,金属性最强的是(
)
A.氯 B.硫 C.铝 D.钠
5.下列物质中,不与水反应的是( )
A.Cl2 B.SiO2 C.SO2 D.Na2O2
6.烷烃的通式是( )
A.CnH2n+2 B.CnH2n C.CnH2n—2 D.CnH2n—6
7.下列物质中,不属于通常所说的三大合成材料的是(
)
A.蛋白质 B.塑料 C.合成纤维 D.合成橡胶
8.下列气体中,能使品红溶液褪色的是( )
A.N2 B.CO2 C.SO2 D.CH4
9.在实验室,下列试剂通常保存在棕色试剂瓶中的是(
)
A.浓硫酸 B.浓硝酸 C.浓盐酸 D.冰醋酸
10.碳元素的一种同位素![]() 具有放射性。在考古研究中,可通过测定
具有放射性。在考古研究中,可通过测定![]() 的含量来判断古化石的地质年代。
的含量来判断古化石的地质年代。![]() 原子核内的中子数是( )
原子核内的中子数是( )
A.6 B.8 C.14 D.20
11.将少量氯水加入到下列溶液中,溶液呈蓝色的是(
)
A.KI溶液 B.淀粉溶液 C.KI和淀粉的混合溶液 D.NaOH溶液
12.环境污染已成为人类社会面临的重大威胁,下列情况不会造成环境污染的是(
)
A.工业上大量燃烧含硫燃 B.随意抛弃塑料垃圾 C.汽车尾气大量排放 D.开发使用新能源氢气
13.下列原子结构示意图中,表示氮原子的是(
)
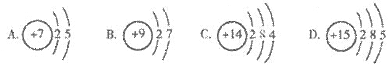
14.下列各组物质中,互为同素异形体的是(
)
A.水和重水 B.氧化钠和过氧化钠 C.冰和干冰 D.氧气和臭氧
15.下列各组物质中,互为同分异构体的是( )
A.CH4和C2H6 B.CH2=CH2和CH![]() CH
CH
C.CH3CH2CH3和CH2=CHCH3 D.CH2=CHCH2CH3和CH3CH=CHCH3
16.下列反应中,属于取代反应的是( )
A.CH2=CH2+H2O![]() CH3—CH2OH
CH3—CH2OH

D.CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
17.下列各组物质中,常温下发生反应并放出红棕色气体的是(
)
A.铜和浓硫酸 B.铜和浓硝酸 C.铜和浓盐酸
D.铁和稀硫酸
18.在标准状况下,32g甲烷气体的体积约为( )
A.5.6L B.11.2L C.22.4L D.44.8L
19.下列试剂可用于检验溶液中Cl—的是(
)
A.紫色石蕊试液 B.硝酸银溶液和稀硝酸 C.澄清石灰水
D.硝酸钡溶液和稀硝酸
20.下列说法中,不正确的是( )
A.氨气可用于制造氮肥 B.氯气可用于消毒和制造漂白粉 C.蔗糖可以食用 D.用工业酒精勾兑的白酒可以饮用
21.下列实验操作中,正确的是( )
A.用托盘天平称量药品时,左盘放药品,右盘放砝码
 B.用烧杯作容器,给液体物质加热时,不需要垫石棉网
B.用烧杯作容器,给液体物质加热时,不需要垫石棉网
C.氢氧化钠固体在烧杯中溶解后,立即将溶液注入到容量瓶中
D.在中和滴定实验时,将氢氧化钠溶液注入酸式滴定管
22.如图所示,在锌、铜和稀硫酸组成的原电池中,下列关于电极的判断,正确的是( )
①Zn是负极 ②Zn是正极 ③Cu是负极 ④Cu是正极
A.①③ B.①④ C.②③ D.②④
23.下列反应中,属于氧化还原反应的是( )
A.Na2O+H2O=2NaOH
B.2Na2O2+2CO2=2Na2CO3+O2
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O D.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
24.当稀硫酸与稀氢氧化钠溶液恰好完全中和时,一定相等的量是(
)
A.原溶液中,H2SO4和NaOH的质量 B.原溶液中,H2SO4和NaOH的物质的量
C.原溶液中,H+和OH—的物质的量浓度 D.原溶液中,H+和OH—的物质的量
25.一定条件下,在2L的密闭容器中通入4.0mol的氮气和适量的氢气,发生反应:N2(g)+3H2(g)![]() 2NH3(g)。经过5s后,测得氮气还剩余3.0mol,在这5s内氮气的反应速率为(
)
2NH3(g)。经过5s后,测得氮气还剩余3.0mol,在这5s内氮气的反应速率为(
)
A.0.6mol/(L·s) B.0.5mol/(L·s) C.0.1mol/(L·s) D.0.05mol/(L·s)
第 Ⅱ 卷(共50分)
一、填空题(共24分)
1.(3分)碳酸氢钠俗称___________,在焰色反应中呈_________色。2mol NaHCO3中含有________molO。
2.(3分)在①Cl2、②KCl、③NaOH三种物质中,只含离子键的是___________(填序号,下同),只含共价键的是___________,既含共价键又含离子键的是___________。
3.(3分)在第三周期元素中,原子半径最小的元素是___________(填元素符号);单质可作为半导体材料的是___________(填名称);具有两性的氢氧化物是__________(填化学式)。
4.(3分)在①淀粉、②纤维素、③蛋白质、④油脂四种物质中,可用于造纸的是___________(填序号,下同);能发生皂化反应的是___________;水解的最终产物为氨基酸的是___________。
5.(3分)在①氯化钾、②醋酸钠、③碳酸钠、④氯化铵四种盐溶液中,常温下溶液呈酸性的是___________(填序号,下同),溶液呈中性的是___________,溶液呈碱性的是___________。
6.(3分)铁和铝是两种重要的常见金属。请回答:
(1)将烧得红热的铁丝伸到盛有氯气的集气瓶中,可观察到有棕黄色的烟生成。该反应的化学方程式为______。
(2)常温下,将铁、铝放入浓硝酸中,可发生钝化现象,这是由于浓硝酸具有__________性。
(3)下列反应中,可用于焊接钢轨的是___________(填序号)。
①3CO+Fe2O3![]() 2Fe+3CO2 ②2Al+Fe2O3
2Fe+3CO2 ②2Al+Fe2O3![]() 2Fe+Al2O3 ③3Fe+4H2O(g)
2Fe+Al2O3 ③3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
7.(6分)X、Y、Z代表三种短周期元素,其原子序数依次减小。X元素原子的次外层电子数是最外层电子数的![]() ,Y元素原子的核外电子总数与其最外层电子数之比为3∶2,Z元素原子的电子层数等于其核外电子数。现有甲、乙、丙三种中学化学中常见的物质,均由X、Y、Z元素中的两种或三种组成。
,Y元素原子的核外电子总数与其最外层电子数之比为3∶2,Z元素原子的电子层数等于其核外电子数。现有甲、乙、丙三种中学化学中常见的物质,均由X、Y、Z元素中的两种或三种组成。
请回答:
(1)甲物质只含有两种元素,在标准状况下为气态,实验测知甲在标准状况下的密度为1.25g/L。用甲直接合成的高分子化合物是一种生活中常见的塑料,该合成反应的化学方程式为______________________。
(2)乙物质含有三种元素,其中X、Y、Z三种元素的质量比为4∶6∶1,乙物质氧化可得到丙(丙的相对分子质量为60)。在实验室可用新制Cu(OH)2悬浊液检验乙分子中的官能团,简述实验操作方法和现象:_______________。
(3)丙物质水溶液呈弱酸性,其电离方程式为_______________________________。
二、实验题(共18分)
8.(4分)在实验室制备乙烯的装置如图所示,仪器A的名称是_______,A中加入的两种试剂分别是_______和_______,收集乙烯的方法是__________。
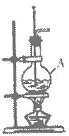
9.(4分)某同学进行如下实验,以检验反应中的能量变化。请回答:
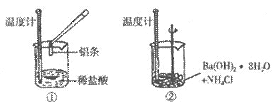 (1)实验中发现:反应后①中的温度升高、②中的温度降低。由此判断铝与盐酸的反应是_______热反应、Ba(OH)2·8H2O与NH4Cl的反应是_______热反应。
(1)实验中发现:反应后①中的温度升高、②中的温度降低。由此判断铝与盐酸的反应是_______热反应、Ba(OH)2·8H2O与NH4Cl的反应是_______热反应。
(2)①中反应的离子方程式为_________________________;在该反应中,还原剂是_______。
10.(4分)某同学在实验室制取氨气的实验装置如图所示。
请回答:
(1)该同学的实验装置中有一个明显的错误是_____________________________。
(2)实验室制氨气的化学方_____________________________。
(3)该同学用镊子夹取湿润的红色石蕊试纸靠近试管口,可观察到试纸变蓝,该现象说明氨气溶于水,溶液呈_______性。
(4)在改正(1)中的错误后,若要制取干燥的氨气,还应如何改进装置?______________________________。
11.(6分)为测定某硫酸钠样品(含有碳酸钠杂质)的纯度,某研究性学习小组的同学进行了如下实验:
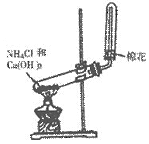
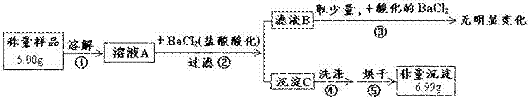
请回答:
(1)操作③的目的是______________________。
(2)原样品中硫酸钠的质量分数为___________%。
(3)若测定结果偏高,其原因可能是下列情况中的___________(填字母)。
a.滤液B中含有Ba2+ b.操作②中盐酸量不足
c.操作④中沉淀没有洗涤干净 d.操作⑤中固体未完全烘干
三、计算题(共8分)
12.(4分)将标准状况下4.48LHCl气体,通入足量的硝酸银溶液中,充分反应。试计算(结果精确到0.1):
(1)生成氯化银的物质的量为多少?
(2)生成氯化银的质量为多少克?
13.(4分)某学校研究性学习小组的同学,到一工厂进行研究实践活动。
(1)同学们收集到该工厂附近的酸雨样品,经测定其中含有的主要离子及其物质的量浓度如下:c(Na+)=1.5×10—4mol/L,c(Mg2+)=4.0×10—5mol/L,c(NH4+)=1.8×10—4
mol/L,c(Cl—)=4.0×10—4mol/L,c(SO42—)=1.2×10—5mol/L试计算该酸雨样品中c(H+)=__________mol/L(其他离子忽略不计)。
(2)经调查,该工厂每天排放含SO2的体积分数为0.112%的废气5000m3(标准状况)。为了防止污染、保护环境,同学们提出了一个治理方案:用氨水(溶质的质量分数为10%、溶液的密度为0.96g/cm3)吸收废气中的SO2,同时得到亚硫酸铵。按此方案,试计算每天消耗氨水的体积最少为________(忽略CO2和盐的水解的影响,结果精确到0.1)。
参考答案北京市夏季普通高中毕业会考
选择题(每小题2分,共50分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| C | A | D | D | B | A | A | C | B | B | C | D | A |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
| D | D | C | B | D | B | D | A | B | B | D | C |
|
一、填空题(共24分)
1.(3分) 小苏打 (1分) 黄 (1分) 6 (1分)
2.(3分) ② (1分) ① (1分) ③ (1分)
3.(3分) Cl (1分) 硅 (1分) Al(OH)3 (1分)
4.(3分)② (1分) ④ (1分) ③ (1分)
5.(3分) ④ (1分) ① (1分) ②③ (1分)
6.(3分) (1)2Fe+3Cl2![]() 2FeCl3 (1分) (2)强氧化(1分) (3)②(1分)
2FeCl3 (1分) (2)强氧化(1分) (3)②(1分)
7.(6分)
(1)![]() (2分)
(2分)
(2)向新制Cu(OH)2悬浊液中加入适量乙物质,加热,产生红色沉淀 (2分)
(3)CH3COOH![]() CH3COO—+H+
(2分)
CH3COO—+H+
(2分)
二、实验题(共18分)
8.(4分)圆底烧瓶 (1分) 无水乙醇 (1分) 浓硫酸 (1分) 排水取气法 (1分)
9.(4分)(1)放 (1分) 吸 (1分) (2)2Al+6H+=2Al3++3H2↑ (1分)
Al(或铝) (1分)
10.(4分) (1)加热的试管管口向上倾斜(或答“应该略向下倾斜”) (1分)
(2)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O (1分) (3)碱 (1分) (4)在收集氨气的试管前增加干燥装置 (1分)
CaCl2+2NH3↑+2H2O (1分) (3)碱 (1分) (4)在收集氨气的试管前增加干燥装置 (1分)
11.(6分) (1)检验溶液中的SO42—是否沉淀完全 (2分) (2)85.2 (2分) (3)b、c、d (2分)
三、计算题(共8分)
12.(4分) 解: ![]() (1分)
(1分)
HCl+AgNO3=AgCl↓+HNO3(1分)
1 1
0.2mol n(AgCl)
(1)![]() (1分)
(1分)
(2)m(AgCl)=0.2mol×143.5g/mol=28.7g (1分)
答:(略)
13.(4分) (1)1.4×10—5 (2分)
(2)88.5 (2分)