第三章 水溶液中的离子平衡 检测
第一卷 选择题(60分)
(可能用到的相对原子质量:H 1,Ba 137,O 16,Na 23,S 32 )
一.选择题(每题有且只有一个正确答案)
1.下列化合物属于弱电解质的是( )
A. HCIO4 B. Ba(OH)2 C. CO2 D. HF
2.下列溶液中加入少量NaOH固体导电能力变化不大的是( )
A. 盐酸 B. CH3COOH C. NH3·H2O D. H2O
3. 0.1 mol/L的CH3COOH溶液达到电离平衡时( )
A. c(CH3COO— ) = c( H+ ) B. c(CH3COOH) = 0.1mol/L
C. c(CH3COOH) < c(CH3COO— ) D. c(H+) = c(OH— )
4. 0.05mol/L的Ba(OH)2溶液,pH为( )
A. 12.7 B. 12.0 C. 13.0 D.13.7
5. pH值为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为( )
A. pH>7 B. pH< 7 C. pH=7 D.无法判断
6.0.1mol/L的HCI和0.1mol/L的NaOH溶液等体积混合后,溶液pH( )
A. pH<7 B. pH> 7 C. pH=7 D.无法判断
7. 250C时,某溶液中由水电离出的c(OH—)=1×10—13 mol/L,该溶液中一定不能大量共存的离子组是( )
A. NH4+ 、Fe3+ 、SO42— 、Cl— B. CO32— 、PO43— 、K+ 、Na+
C. Na+ 、SO42— 、NO3— 、Cl— D. HPO42— 、 Na+ 、 HSO3— 、K+
8.一定温度下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH—)之比为( )
A. 大于10 B. 小于10 C. 等于10 D. 无法确定
9. 50mL的酸式滴定管中,某浓度HCl溶液在30mL处,则该HCl溶液的体积为( )
A.大于30mL B. 等于30mL C. 大于20mL D.等于20mL
10. 下列试纸,使用时预先不能用蒸馏水润湿的是( )
A. 红色石蕊试纸 B. 蓝色石蕊试纸 C. 淀粉KI试纸 D. pH试纸
二.选择题(每题有一或二个正确的答案)
11.下列有关强电解质叙述正确的是( )
A. 离子化合物一定是强电解质
B. 强电解质在熔化状态下一定能够导电
C. 具有强极性键的共价化合物可能是强电解质
D. 强电解质的水溶液一定具有很强的导电能力
12. 下列离子反应方程书写正确的是( )
A. H2O
+ H2O ![]() H3O+ + OH— B. CO32—+ 2H2O
H3O+ + OH— B. CO32—+ 2H2O![]() H2CO3
+ 2OH—
H2CO3
+ 2OH—
![]()
![]() C. Ca(OH)2 + 2H+
C. Ca(OH)2 + 2H+ ![]() Ca2+ + 2H2O
D.2Al3++3CO32—+3H2O = 2Al(OH)3 +3CO2
Ca2+ + 2H2O
D.2Al3++3CO32—+3H2O = 2Al(OH)3 +3CO2
13.下列离子在pH=1的溶液中能够大量共存的是( )
A. F—、Na+、K+、Cl— B. Ca2+、K+、Cl—、NO3—
C. Fe2+、NO3—、K+、Cl— D. Al3+、AlO2—、K+、Cl—
14.可促进HClO的电离,并使pH增大的是( )
①加入HCl ②加入NaClO ③加入NaOH ④加入Zn ⑤加热
A.①②③④ B. ②③④ C. ③④ D. ③④⑤
15.工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量盐酸中,为了除去杂质需调节溶液的pH到4,应加入的试剂是( )
A. NaOH B. NH3·H2O C.ZnO D. ZnCl2
16.NH4Cl溶液中,下列叙述错误的是( )
A. c(NH4+)>c(Cl—) >c(OH— ) >c( H+ ) B. c(Cl—)>c(NH4+)>c( H+ )>c(OH— )
C. c(NH4+) + c( H+ ) = c(Cl—) + c(OH— ) D. c(NH4+) + c( NH3 · H2O ) = c(Cl—)
17.下列说法正确的是( )
A.难溶电解质的溶度积越小,溶解度越大
B.可以通过沉淀反应使杂质离子完全沉淀
C.难溶电解质的溶解平衡是一种动态平衡
D.一定浓度的NH4Cl溶液可以溶解Mg(OH)2
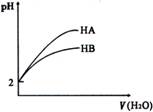 18.pH = 2的两酸HA、HB加水稀释后,溶液pH
18.pH = 2的两酸HA、HB加水稀释后,溶液pH
随加水量的变化曲线如右图所示。则下列叙述
正确的是( )
A.电离平衡常数HA>HB
B.等体积的HA和HB与等浓度的NaOH反应,HA消耗的NaOH多
C.等体积的HA和HB与等质量的Zn反应,HA反应速率大
D.若有等浓度的NaA、NaB,则碱性NaA>NaB
19.在NaCl溶液中含有少量的Na2S,欲将S2—除去,可加入( )
A.稀盐酸 B.AgCl C.NaOH D.Ag2S
20.用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是( )
A.滴定前滴定管中有气泡,滴定后消失
B.碱式滴定管量取NaOH溶液时,未进行润洗操作
C.滴定时达到滴定终点时仰视读数
D.锥形瓶取用NaOH待测液前加少量水洗涤
第二卷 (共40分)
三.填空题(共34分)
21.(3分)下列各物质的溶液物质的量浓度均为0.1mol/L。
①HCl ②NaOH ③Na2CO3 ④CH3COONa
⑤NH4Cl ⑥H2SO4 ⑦KCl ⑧CH3COOH
按它们pH由小到大的排列顺序为 。
22.(3分) 10体积的盐酸和1体积的NaOH混合后,pH=7,则盐酸和NaOH的pH之和是 。
23.(9分)(1)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为 。同时有红褐色沉淀生成,其原因是 。
(2)水玻璃在工业上可作粘合剂,它与NH4Cl溶液接触时,会很快凝结,用离子方程式表示其原因为 。
24.(6分)在氨水中存在如下平衡NH3·H2O![]() NH4+ + OH—,分别加入少量盐酸、NaOH溶液和NH4Cl溶液后,对NH3·H2O的电离平衡各有什么影响? (填 “促进电离”或 “抑制电离”或 “平衡不移动”)
NH4+ + OH—,分别加入少量盐酸、NaOH溶液和NH4Cl溶液后,对NH3·H2O的电离平衡各有什么影响? (填 “促进电离”或 “抑制电离”或 “平衡不移动”)
| 加入的物质 | 少量盐酸 | 少量NaOH 溶 液 | 少量NH4Cl 溶 液 |
| 对电离平衡的影响 |
|
|
|
25.(13分)用化学式和离子符号表示氯水和氨水中分别含有的微粒:
氯水: 、 、 、 、 、 、 ;
氨水: 、 、 、 、 、 ;
四、计算题(6分)
26.在100mL 2mol/L的Ba(OH)2溶液中滴加100mL NaHSO4溶液,测得溶液的pH为1,求产生的沉淀的质量,以及NaHSO4溶液的物质的量浓度。
|
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | A | C | B | C | D | B | C | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AC | AD | B | C | C | A | CD | A | AB | AC |
21. ⑥①⑧⑤⑦④③②。 22. 15 。
23(1)Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
![]() CaCO3 + 2H+ =Ca2+ + H2O +CO2
CaCO3 + 2H+ =Ca2+ + H2O +CO2
![]()
![]() 碳酸钙消耗H+ ,促进氯化铁的水解,使水解产物 Fe(OH)3大量生成,形成红褐色沉淀.(2).SiO32—+ 2NH4+ = 2NH3 + H2SiO3
碳酸钙消耗H+ ,促进氯化铁的水解,使水解产物 Fe(OH)3大量生成,形成红褐色沉淀.(2).SiO32—+ 2NH4+ = 2NH3 + H2SiO3
24.促进电离;抑制电离;抑制电离;
25. Cl2 、 HClO 、 H2O 、 H+ 、 Cl— 、 ClO— OH— ;
NH3 、 H2O NH3·H2O NH4+ OH— H+。
26.m(BaSO4) =46.6g c(NaHSO4)=4.2mol/L
试卷分析:(1~20题为选择题 3分/题)
第一节 弱电解质的电离(共37分)
1、2、3、8、11、18、24(6’)、25(13’)
第二节 水的电离和溶液的酸碱性(共33分)
4、5、6、9、10、14、20、21(3’)、22(3’)、26(6’)
第三节 盐类的水解(共24分)
7、12、13、15、16、23(9’)
第四节 难溶电解质的溶解平衡(共6分)
17、19