高二文科下学期化学期中试题
班级 学号 姓名
| 题 目 | 第I卷 | 第II卷 | 总 分 | ||
| 一 | 二 | 三 | 四 | ||
| 得 分 | |||||
可能用到的相对原子质量: H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27 P—31 S—32 Cl—35.5 K—39 Ca—40 Mn—55 Fe—56 Cu—64 Zn—65 F—19
第I卷 选择题
一、单项选择题 (本题每小题只有一个选项符合题意,每题2分,共60分)
1.下列物质属于纯净物的是( )
A、石油 B、盐酸 C、干冰 D、氯水
2.下列物质属于强电解质的是( )
A、石墨 B、固体氯化钠 C、液态氨水 D、苯酚溶液
3.下列物质久置在敞口容器中,质量会减少的是( )
A、NaOH B、浓硫酸 C、碱石灰 D、硫酸铜晶体
4.下列化合物中,既有离子健又有共价键的是( )
A、NaOH B、HCl C、CaCl2 D、HNO3
5.既能溶解于盐酸,又能溶解于氢氧化钠溶液的是( )
A、MgO B、Al2O3 C、SiO2 D、FeCl3
6.下列原子或离子中,只有两个电子层,最外层有8个电子的是( )
A、Cl - B、F C、Na + D、Ar
7.能鉴别NH4NO3、Na2SO4、(NH4)2SO4、NaCl四瓶溶液的试剂是( )
A、Ba(OH)2 B、Cu(NO3)2 C、AgCl D、KOH
8.下列物质能与溴水反应,产生白色沉淀的是( )
A、AgNO3 B、C6H5OH C、KI D、CH≡CH
9.下列溶液中SO4 2- 浓度最大的是( )
A、150 ml 1 mol/L的硫酸钾溶液
B、300 ml 0.5 mol/L的硫酸镁溶液
C、50 ml 1 mol/L的硫酸铝溶液
D、200 ml 1.5 mol/L的硫酸溶液
10.X为IIA族元素,Y为VIIA族元素,则由X和Y组成的化合物是( )
A、XY2 B、X2Y C、X2Y3 D、X2Y5
11.将KClO3和MnO2混合并充分加热,然后在固体残留物中加入浓硫酸,再经加热,可产生的气体是( )
A、O2 B、SO2 C、HCl D、Cl2和HCl
12.下列反应式不属于氧化还原反应的是( )
A、H2 + Cl2 == 2 HCl
B、2 NaCl + H2SO4(浓) == Na2SO4 + 2 HCl
C、2 Ca(OH)2 + Cl2 == CaCl2 + Ca(ClO)2 + 2 H2O
D、Br2 + 2 KI == 2 KBr + I2
13.由Na2S、Na2SO3、Na2SO4组成的某固体混合物中,已知S的质量分数为25.6%,则氧元素的质量分数是( )
A、36.8% B、37.6% C、51.2% D、无法计算
14.一定量14%的KOH溶液,在蒸发100g水后,其质量分数变为28%,若此时溶液的体积为125 mL,则蒸发后KOH溶液的物质的量浓度是( )
A、4.0mol/L B、6.25mol/L C、2.2mol/L D、5.0mol/L
15.人们把食品分为绿色食品、蓝色食品、白色食品等。绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的食品叫蓝色食品,通过微生物发酵制得的食品叫白色食品。下面属于白色食品的是( )
A、食醋 B、面粉 C、海带 D、花生油
16.在海湾战争期间,科威特大批油田被炸着火。在灭火工作中不能考虑用来灭火的措施是( )
A、设法阻止石油喷射 B、设法降低火焰温度
C、设法降低石油着火点 D、设法使火焰隔绝空气
17.化学工作者从反应:RH + Cl2(g) ——→RCl(l) + HCl(g)受到启发,提出在农药和有机合成工业中可获得副产品盐酸,这种想法已成为现实。试指出上述反应产物所得盐酸可能用到的最佳分离方法是( )
A、蒸馏 B、水洗分液法 C、升华法 D、有机溶剂萃取法
18.能说明苯分子苯环的平面正六边形结构中,碳碳键不是单双键交替排布的事实是( )
A、苯的一元取代物没有同分异构体
B、苯的间位二元取代物只有一种
C、苯的邻位二元取代物只有一种
D、苯的对位二元取代物只有一种
19.从石油分馏得到的固体石蜡,用氯气漂白后,燃烧时会产生含有氯元素的气体,这是由于石蜡在漂白时与氯气发生了( )
A、加成反应 B、取代反应 C、聚合反应 D、催化裂化反应
20.瑞典皇家科学院2001年10月10日宣布,2001年诺贝尔化学奖授予“手性催化氢化、氧化反应”美国诺贝斯、夏普雷斯和美籍日本化学家野依良治三位科学家。在有机物分子中,若某个碳原子上直接连接有四个不同的原子或原子团时,将这种碳原子命名为“手性碳原子”,含有“手性碳原子”的分子称为“手性分子”。这类“手性分子”可以用作某些化学反应的催化剂,为有机合成开辟了一个全新的领域。下列分子中含有“手性碳原子”的是( )
A、CBr2F2 B、CH3CH2OH C、CH3CH2 CH3 D、CH3CH2(OH)COOH
21.能证明乙醇分子中含有一个羟基的事实是( )
A、乙醇完全燃烧生成CO2和H2O
B、0.1 mol乙醇与足量钠反应,生成0.05 mol氢气
C、乙醇能溶解于水
D、乙醇能够发生脱水反应
22.2000年我国药品监督管理局发布通知,要求暂停使用和销售含有PPA的药品制剂。PPA是苯丙醇胺的简称,其结构简式如右下图所示,下列关于PPA的说法中不正确的是( )
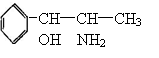 A、能与氢气发生加成反应
A、能与氢气发生加成反应
B、能发生酯化和消去反应
C、既能与盐酸反应,又能与烧碱溶液反应
D、不能与FeCl3溶液发生显色反应
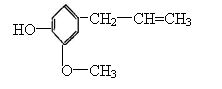 23.丁香油酚是一种有特殊香味的液体,它的结构简式如下图所示,则丁香油酚不具有的性质是( )
23.丁香油酚是一种有特殊香味的液体,它的结构简式如下图所示,则丁香油酚不具有的性质是( )
A、与金属钠反应
B、与氢氧化钠溶液反应
C、与Na2CO3反应放出CO2
D、能发生加聚反应
|
酱油中3-氯丙醇的含量不得超过1ppm。
3-氯丙醇分子式为ClCH2CH2CH2OH,则
分子中不含有右图结构的共有( )
A、2种 B、3种 C、4种 D、5种
25.洗涤下列试管时,选用的试剂(括号内的物质)不妥的是( )
A、做过KMnO4分解实验的试管(浓盐酸)
B、做过木炭还原氧化铜实验的试管(硝酸)
C、做过银镜反应实验的试管(氨水)
D、做过苯酚溶解性实验的试管(酒精)
26.从深海鱼的油中提取的被称为“脑黄金”的DHA是一种不饱和程度很高的脂肪酸,它的分子中含有6个碳碳双键,学名叫二十二碳六烯酸。它的分子组成应当是( )
A、C20H41COOH B、C21H31COOH
C、C21H33COOH D、C22H33COOH
27.某学生做麦芽糖的还原性实验。取出4 ml 0.5 mol/L的CuSO4溶液与4 ml 0.5 mol/L的NaOH溶液混合后,滴入1.0 ml10%的麦芽糖溶液,加热煮沸。结果没有看到红色沉淀。这是因为( )
A、麦芽糖浓度太高 B、加热时间不够
C、CuSO4溶液的量不够 D、NaOH溶液的量不够
28.糖元[(C6H10O5)n]是一种相对分子质量比淀粉更大的多糖,主要存在于肝脏的肌肉中,所以又叫动物淀粉或肝糖。下列叙述正确的是( )
A、糖元与淀粉、纤维素互为同分异构体
B、糖元、淀粉、纤维素属于同系物
C、糖元水解的最终产物是葡萄糖
D、糖元只有还原性,能发生银镜反应
29.1997年英国的“克隆羊”备受关注。克隆的关键技术之一是找到一些特殊的酶,这些酶能激活普通体细胞,使之像生殖细胞一样发育成个体。下列关于酶的说法中不正确的是( )
A、酶是具有催化作用的蛋白质
B、酶的催化作用具有选择性和专一性
C、高温或重金属盐能降低酶的活性
D、酶只有在强酸或强碱条件下才能发挥作用
30.通常把原子数和电子数相等的分子或离子称为等电子体。人们发现等电子体间的结构、性质相似,即等电子体原理。B3N3H6与C6H6是等电子体,称为“无机苯”。下列对B3N3H6说法中不正确的是( )
A、各原子在同一平面上 B、有碱性
C、能发生加成、取代反应 D、能使酸性KMnO4溶液褪色
第 II卷 非选择题
二、填空题。(每空2分,共24分)
31.配平方程: H2S + HNO3 == NO + S + H2O
32.某醛的结构简式为(CH3)2C=CHCH2CH2CHO。回答下列问题:
(1)检验分子中醛基的方法为: ;
(2)检验分子中含有-C=C-的方法为: ;
(3)在实验操作中,哪一个官能团应先检验? 。
33.已知A、B、C、D四种元素都是短周期元素,A的单质在相同条件下是密度最小的气体,B和C位于同一周期,C和D在同一主族,D的二价阴离子与氩原子具有相同的电子层结构,A与B在一定条件下能生成一种碱性的气体。判断: [(1)中每空1分]
(1)写出它们的元素符号:A 、B 、C 、D 。
(2)写出元素最高价氧化物的水化物化学式:B 、D 。
34.(1)写出烧碱溶液与玻璃成分反应的化学方程式:
。
(2)潮水艇内常用过氧化钠来提供氧气,写出反应的化学方程式:
。
35.写出符合下列要求的任意一个反应方程式。
(1)取代反应: ;
(2)加成反应: 。
三、实验题。(每空2分,共12分)
36.实验室制取乙烯常常因温度过高而使乙醇与浓硫酸反应生成少量的二氧化硫,有人设计了以下右图所示装置来确证上述反应后混合气体中含有乙烯和二氧化硫。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中应盛放
的试剂是:Ⅰ ,Ⅱ ,
Ⅲ ,Ⅳ 。(选择以下试
剂的序号填空)。(每空1分)
A、品红溶液 B、NaOH溶液
C、浓硫酸 D、酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是 ;
(3)使用装置Ⅱ的目的是 ;
(4)使用装置Ⅲ的目的是 ;
(5)确证含有乙烯的现象是 。
四、计算题。(本题4分)
37.将NaHCO3和Na2CO3 ·10H2O的混合物3.28g溶解于水,配成100 ml溶液,测得此溶液中Na + 的浓度为0.25 mol/L。若另取一份相同质量的混合物,充分加热至质量不再发生变化为止,则质量减少多少g。